聚焦 mRNA 质控!瀚海新酶牵头三项团体标准正式发布,引领行业规范发展
实时资讯
mRNA技术具备多项优势:安全高效、生产周期短成本低、能适应快速变异的病毒、能够引起体液免疫和细胞免疫的双重反应,免疫原性强、无需佐剂、适合多种疾病等。这些优势使得mRNA技术在应对传染病和开发新型治疗方法方面具有广阔的应用前景。随着此项技术的研究不断深入,mRNA的质量控制也越来越重要和严格。
瀚海新酶作为 mRNA 原料及质控试剂盒开发的领先者,经过大量的实验和严谨的方法学验证,建立了dsRNA定量检测、DNase残留检测、RNase残留检测等三个重要质控项目的检测方法,并被多家企业应用到研发和生产中。
作为中国食品药品企业质量安全促进会的副会长单位,瀚海新酶牵头国内mRNA多家头部企业和知名高校编写了dsRNA定量检测、DNase残留检测、RNase残留检测、T7 RNA聚合酶残留检测等mRNA质控检测方法及标准。
其中:
《mRNA 疫苗及药物中 dsRNA 杂质定量检测 ELISA 法》(T/FDSA 0058-2024)、
《生物制品中 DNase 残留检测 核酸荧光底物法》(T/FDSA 0059-2024)
《生物制品中 RNase 残留检测 核酸荧光底物法》(T/FDSA 0060-2024)
三项团体标准,经过严格的权威专家团立项评审、公示和结项评审,历时数月,三项团体标准,于2024年11月14日正式发布。
2024年11月15日,由中国食药促进会疫苗及生物制品质量评价与标准专业委员会组织全国30多家企事业单位共同编制的《基于mRNA-LNP技术的(细胞)免疫治疗产品开发指南》(T/FDSA 0055-2024)团体标准正式发布会,在深圳召开。
该标准详细规定了基于mRNA-LNP技术开发(细胞)免疫治疗产品的技术路线、制备工艺、检验方法、质控要点、功能验证等方面内容,以及研发生产所需的管理、组织、人员、设施设备及物料等相关要求。为科研机构、生产企业提供了明确的技术指导和产品规范,特别是在不同技术路线的产品设计、质控指标等方面,标准提出了具体要求,旨在推动mRNA-LNP技术的持续优化与创新。瀚海新酶作为参编单位,以上方法也收录在此标准中。

瀚海新酶研发中心 耿玉杰 博士 出席(左起第5位)

《mRNA疫苗及药物中dsRNA杂质定量检测ELISA法》
ELISA 法是 dsRNA 定量检测的主流方法,是 USP《 Analytical Procedures for Quality of mRNA Vaccines and Therapeutics(Draft Guidelines: 3rd Edition)》和《基于 mRNA-LNP 技术的(细胞)免疫治疗产品开发指南》中推荐使用的 dsRNA 检测方法。
因 mRNA 原液中 dsRNA 的长度和序列无法确定,且不同 mRNA 原液中 dsRNA 长度分布也不同,所以在选择 dsRNA 标准品和抗体对时有其特殊的技术考量点,《mRNA 疫苗及药物中 dsRNA 杂质定量检测 ELISA 法》对此做了全面阐述,保障了 dsRNA ELISA 法检测的科学性和准确性。此外,该标准也对 dsRNA ELISA 法检测原理、方法学验证、试剂材料和实验操作、结果分析进行了详细说明。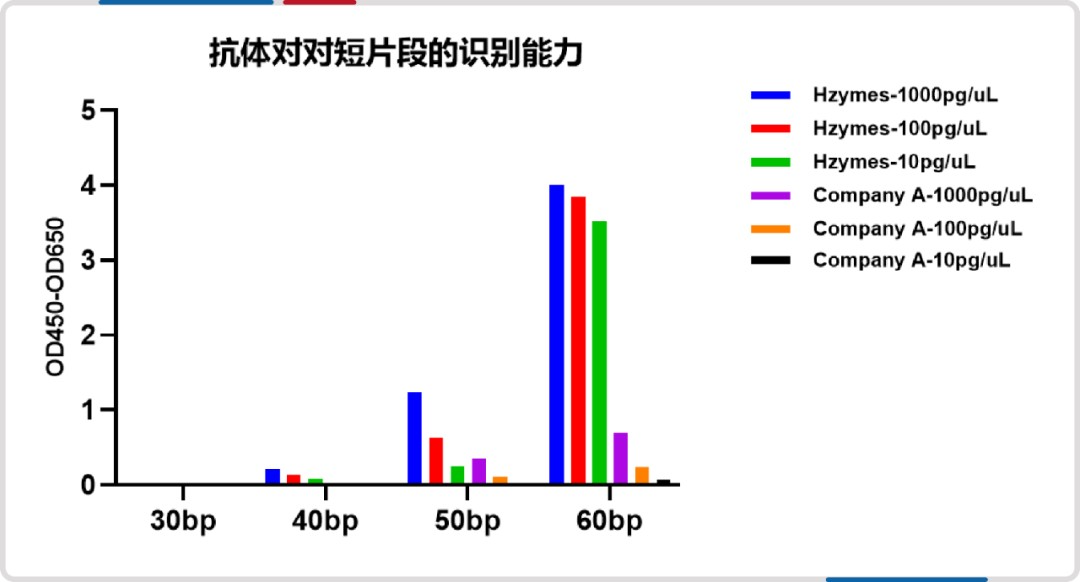
《生物制品中DNase/RNase残留检测核酸荧光底物法》
mRNA 药物及质粒等生物制品在生产过程中,会存在 DNase/RNase 的残留和污染的可能性,包括生物样品中含有的内源性 DNase/RNase,存在于环境、缓冲液、耗材表面、原料等外源性 DNase/RNase。残留 DNase/RNase 如果跟随生物制品进入人体内,有可能引发高强度的免疫原性等反应,引起较严重的安全性风险。因此需要对生物制品的外来物料、耗材和环境等的 DNase/RNase 残留进行准确分析检测,使之控制在安全范围内。
瀚海新酶建立核酸荧光底物法检测生物制品中的 DNase/RNase 残留,通过探针设计优化,解决了三大技术难题:一、不同 DNase/RNase 检测覆盖度的问题;
二、灵敏度提升的问题;
三、复杂样本实用性的问题。并基于研究基础和操作经验在《生物制品中 DNase/RNase 残留检测 核酸荧光底物法》对实验原理、试剂材料和操作分析步骤做了详细说明。
秉承精益求精的企业理念和工匠精神,瀚海新酶将持续助力中国生物药质控技术的发展。
附团体标准公告链接:
https://www.ttbz.org.cn/StandardManage/Detail/116372/
产品信息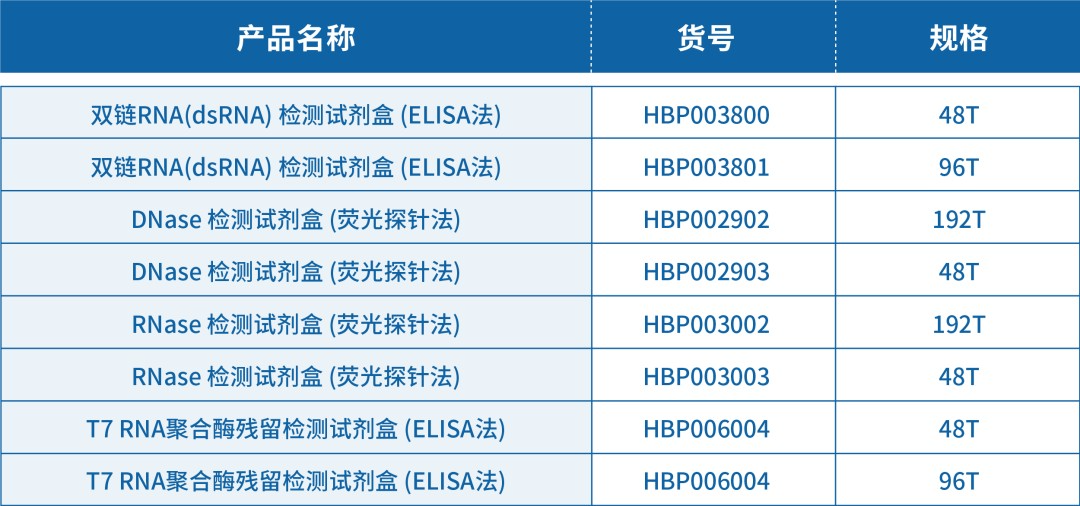










请先 登录后发表评论 ~