mRNA疫苗及药物
mRNA疫苗打破了传统灭活、减毒疫苗的免疫激活模式,创新性地利用人体本身细胞生产抗原,以此激活特异免疫,在新冠疫情期间大放异彩。mRNA疫苗及药物的应用前景非常广阔,除了能够用于预防传染性疾病,治疗肿瘤和免疫疾病,还可应用于多种生物药平台技术中,例如:蛋白补充治疗,细胞疗法,抗体类药物,基因编辑等等。在后新冠疫情时代,mRNA疫苗仍旧具备大幅增长的潜力。
mRNA免疫抗原抗体制备
mRNA具有编码几乎所有蛋白质的潜力。mRNA疫苗技术可以借鉴到抗原制备中, 用来解决蛋白制备困难的问题:如传统蛋白类抗原制备周期长、生产工艺复杂,生产定制的灵活性较差等。mRNA作为一种平台化技术,有着生产工艺简单,生产周期短,灵活性高等优点,可以更快更节约成本地为客户提供抗原的制备,进行快速的靶点可行性验证。
瀚海新酶提供一站式mRNA疫苗&药物开发概念验证服务,助力客户快速验证药物靶点可行性
- 经验丰富的团队,已成功交付多个概念验证项目
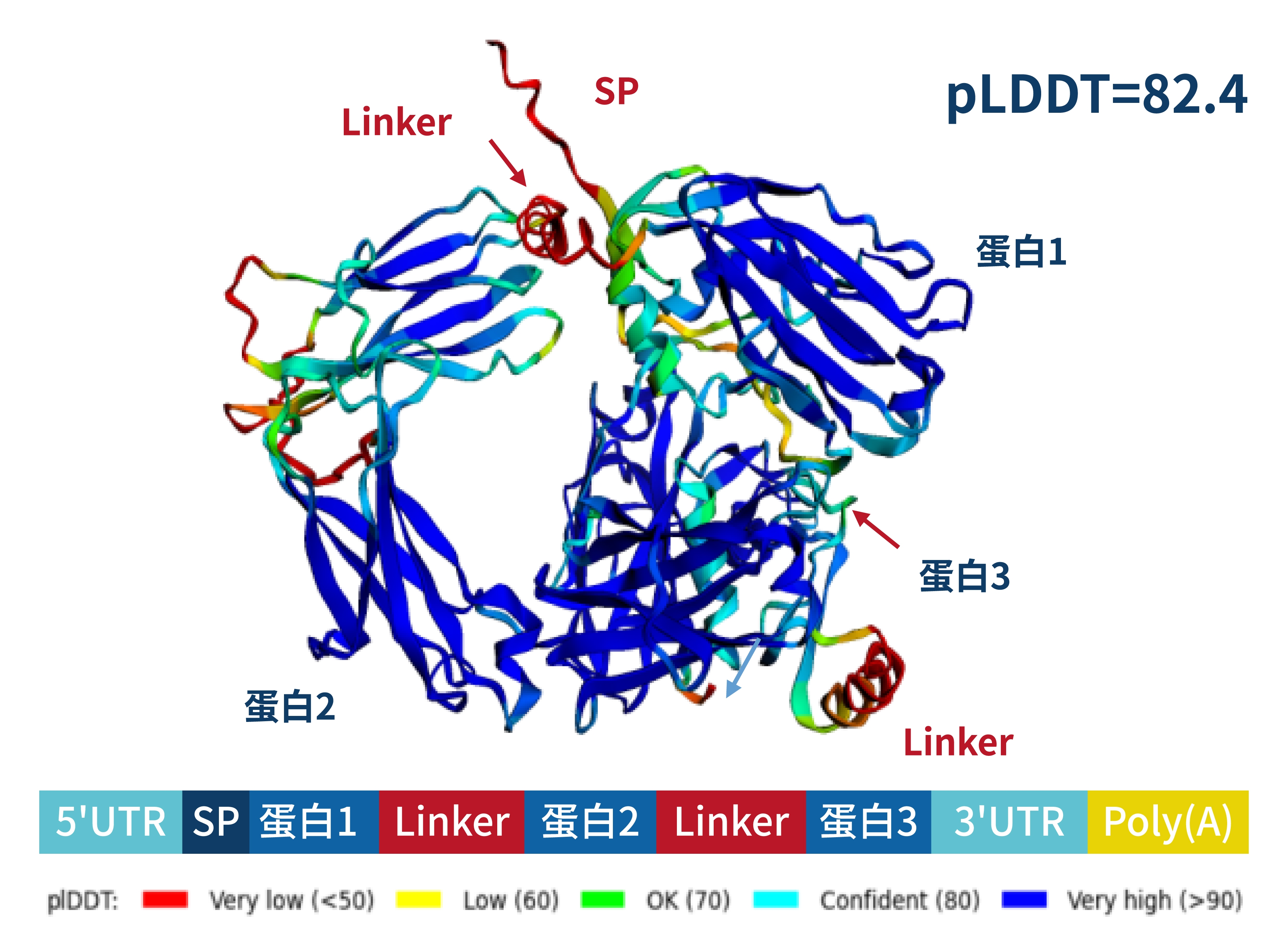
- 多样化的工具,利用alphafold预测蛋白的二级结构,为客户的抗原设计和mRNA序列设计提供指导。
- 自主建立的mRNA技术与应用平台,完善的质量体系,从序列设计、mRNA-LNP制备到体内生物学评估的全流程服务。








服务类别 | 用时(工作日) | 交付 |
序列设计 | 5 | 10条候选序列 |
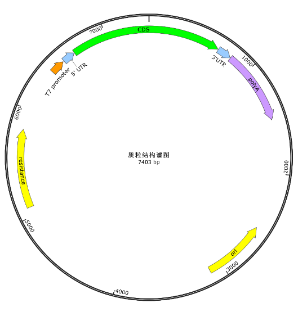
质粒构建扩增 | 30 | 质粒及序列文件,提供合成的原始质粒(1-2μg ) |
mRNA原液合成 | 5 | mRNA原液检测报告 |
mRNA细胞翻译水平检测 | 10 | 翻译水平检测报告 |
LNP包封 | 10 | 1mg LNP |
体内翻译水平检测(可选) | 20 | 检测报告 |
体内细胞免疫检测(可选) | 10 | 检测报告 |
体液免疫检测(可选) | 20 | 检测报告 |
体内翻译水平+体液免疫检测(可选) | 20 | 检测报告 |
体内翻译水平+体液免疫检测+细胞免疫检测(可选) | 20 | 检测报告 |

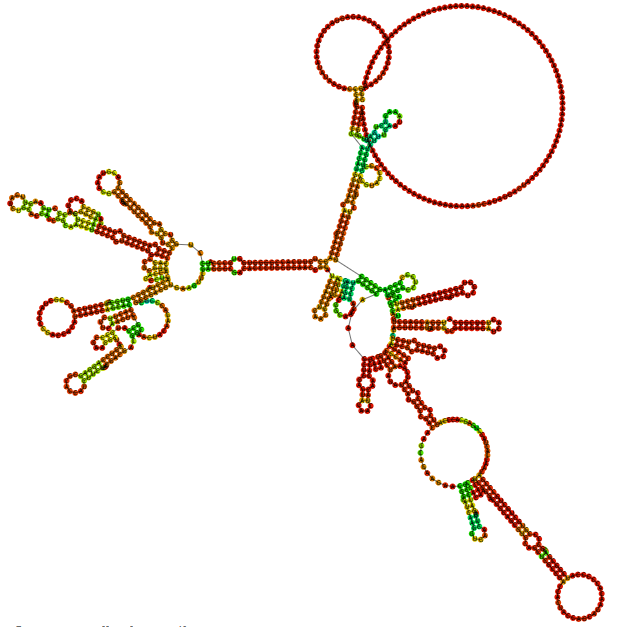
T7启动子+转录起始序列 | IVT产量 | |
saRNA-EGFP(AU,UTP) | TAATACGACTCACTATAATG GGCGGCGCAT | 正常,1:181 |
TAATACGACTCACTATAATG CGGCGCAT | 无产量 | |
TAATACGACTCACTATAAT CGGCGCAT | 无产量 |


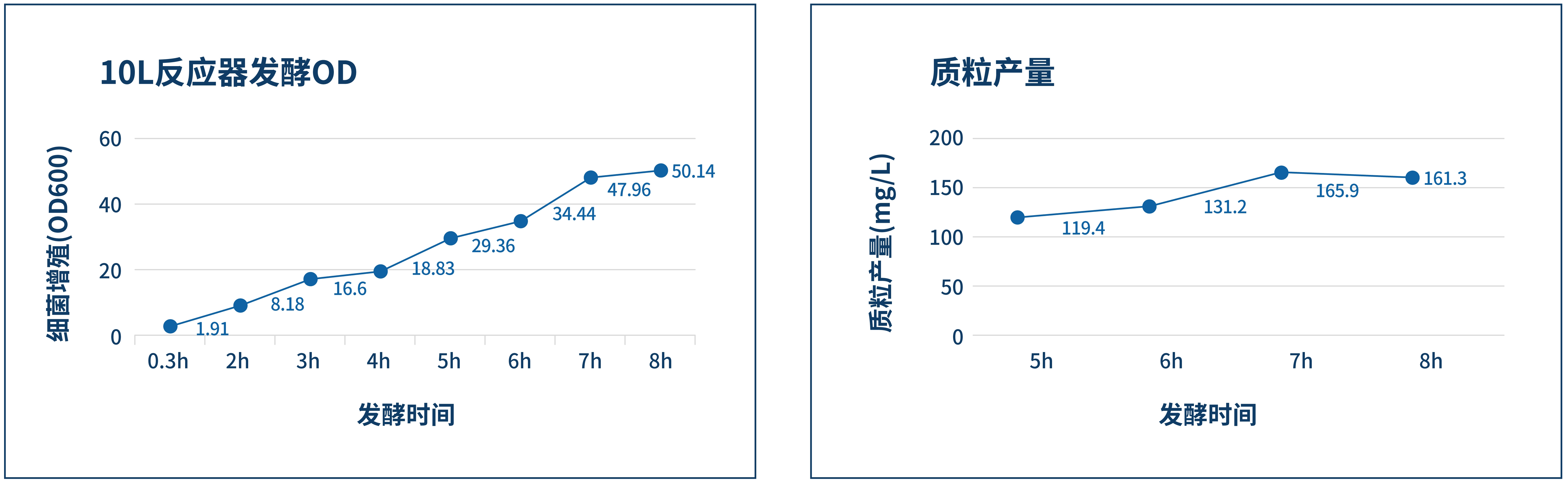
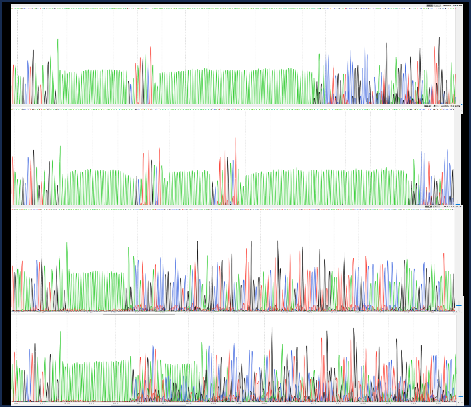
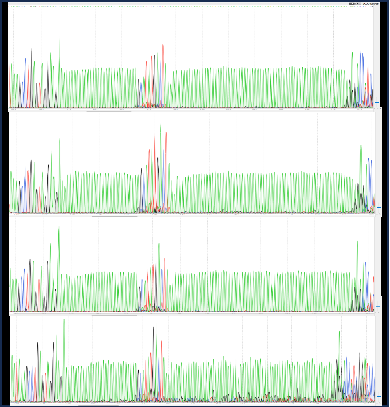
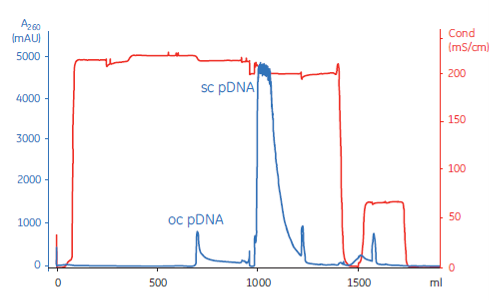
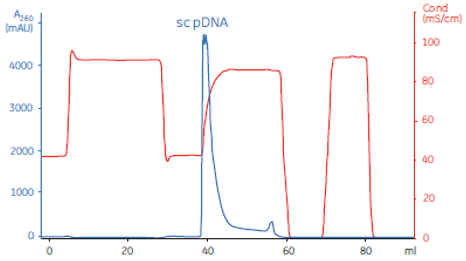
质控项 | 编号 | 检测项目 | 检测方法 |
细菌种子库检验 | 1 | 细菌形态 | 显微观察 |
2 | 质粒限制性酶切图谱 | 限制性内切酶切 | |
3 | 目的基因测序 | 测序 | |
4 | 其他元件测序 | 测序 | |
5 | 细菌鉴别 | 培养法/细菌染色/生化反应 | |
6 | 抗生素抗性 | 培养法 | |
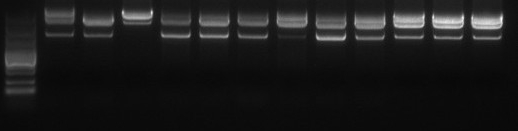
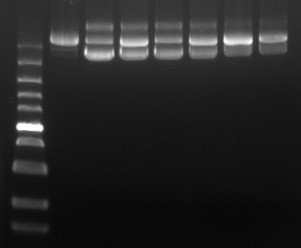
菌种传代稳定性 | 1 | 质粒序列大小 | 电泳/测序 |
2 | 质粒序列准确性 | 测序 | |
3 | 质粒限制性酶切图谱 | 限制性内切酶切 | |
4 | 质粒拷贝数 | ddPCR | |
5 | 传代代次限制 | 培养法 | |
超螺旋质粒质控 | 1 | 外观 | 目测法 |
2 | PH值 | PH计 | |
3 | 纯度(A260/A280) | 紫外分光光度计 | |
4 | 限制性内切酶鉴定 | 琼脂糖凝胶 | |
5 | 测序鉴定 | 测序 | |
6 | 浓度 | 分光光度法 | |
7 | DNA同质性 | 电泳法或HPLC | |
8 | 宿主蛋白残留 | Elisa | |
9 | RNA残留 | 电泳法 | |
10 | 宿主DNA残留 | QPCR | |
11 | 微生物限度/无菌 | 薄膜过滤法 | |
12 | 内毒素 | 鲎试剂 |
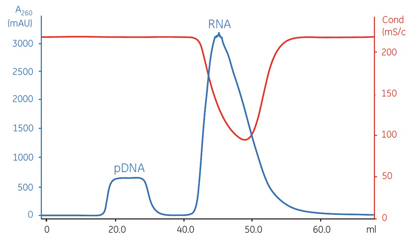

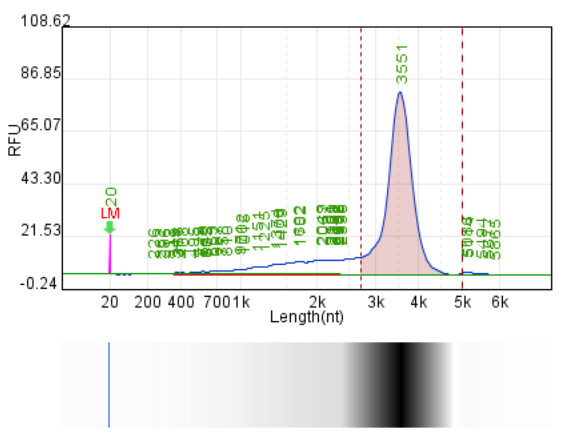



WT-T7 (客户体系)
产量:191.9μg/20μL反应
完整度:75.6%
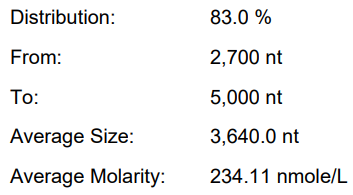
替换M6/酶用量优化
产量:176.8μg/20μL反应
完整度:83.0%
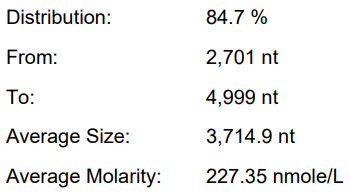
数据库分析及Buffer优化
产量:240.1μg/20μL反应
完整度:84.7%
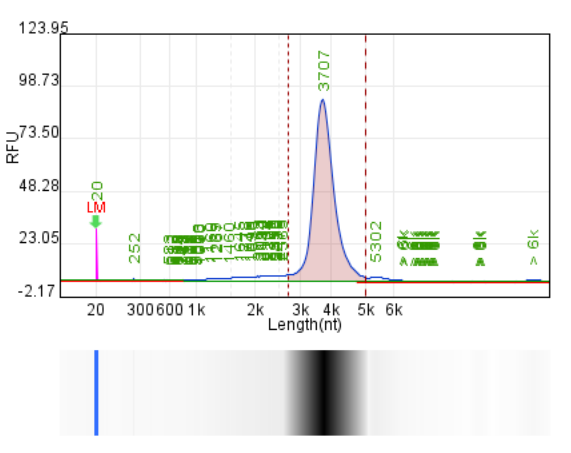
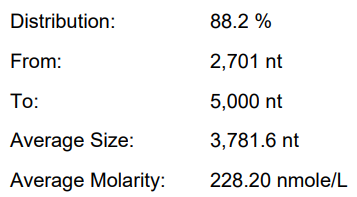
使用增强剂(终IVT体系)
产量:203.8μg/20μL反应
完整度:88.2%
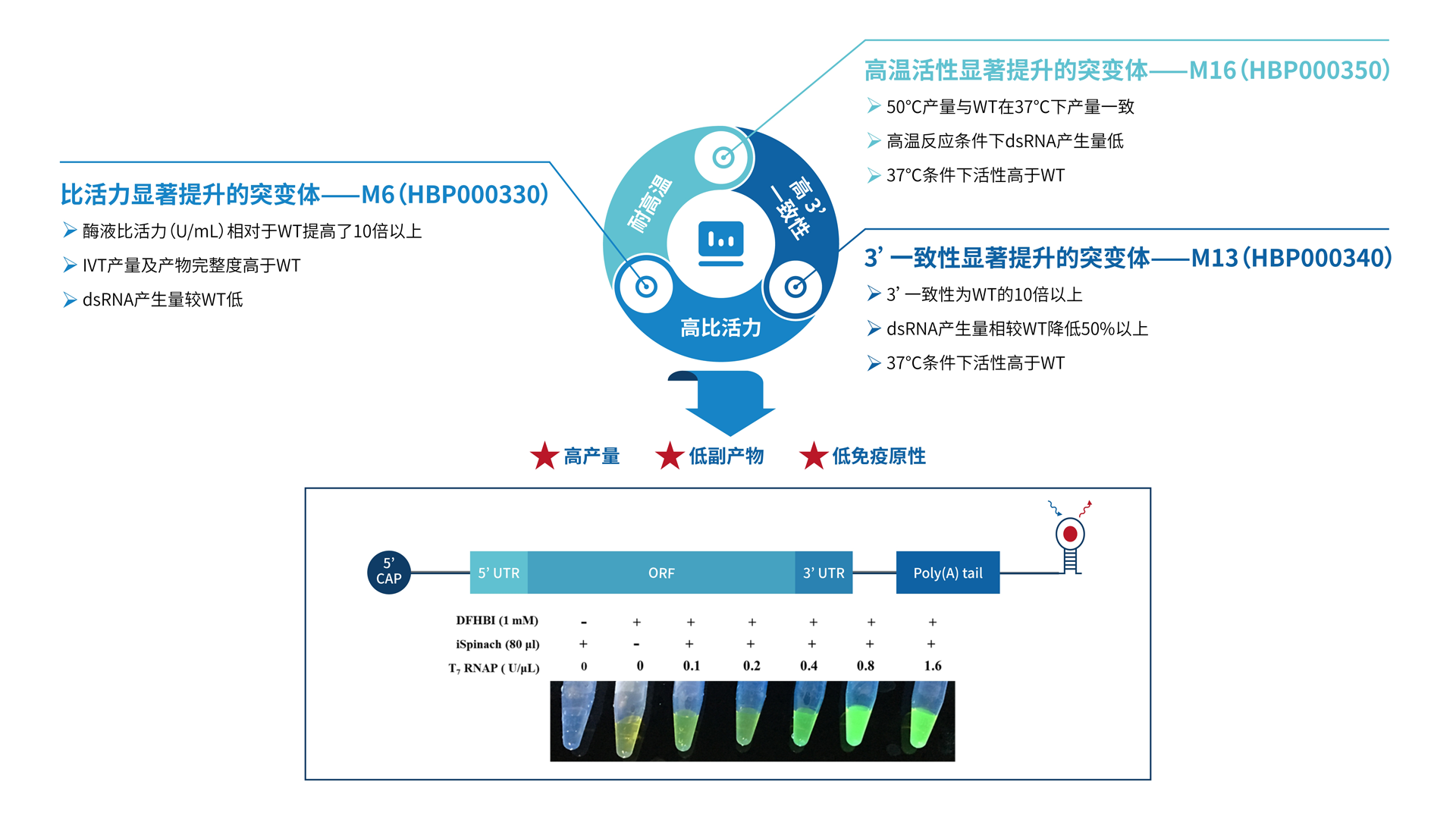
产品放行检测
质检项 | 质检方法 | 结果展示 |
浓度 | Nanodrop法 | 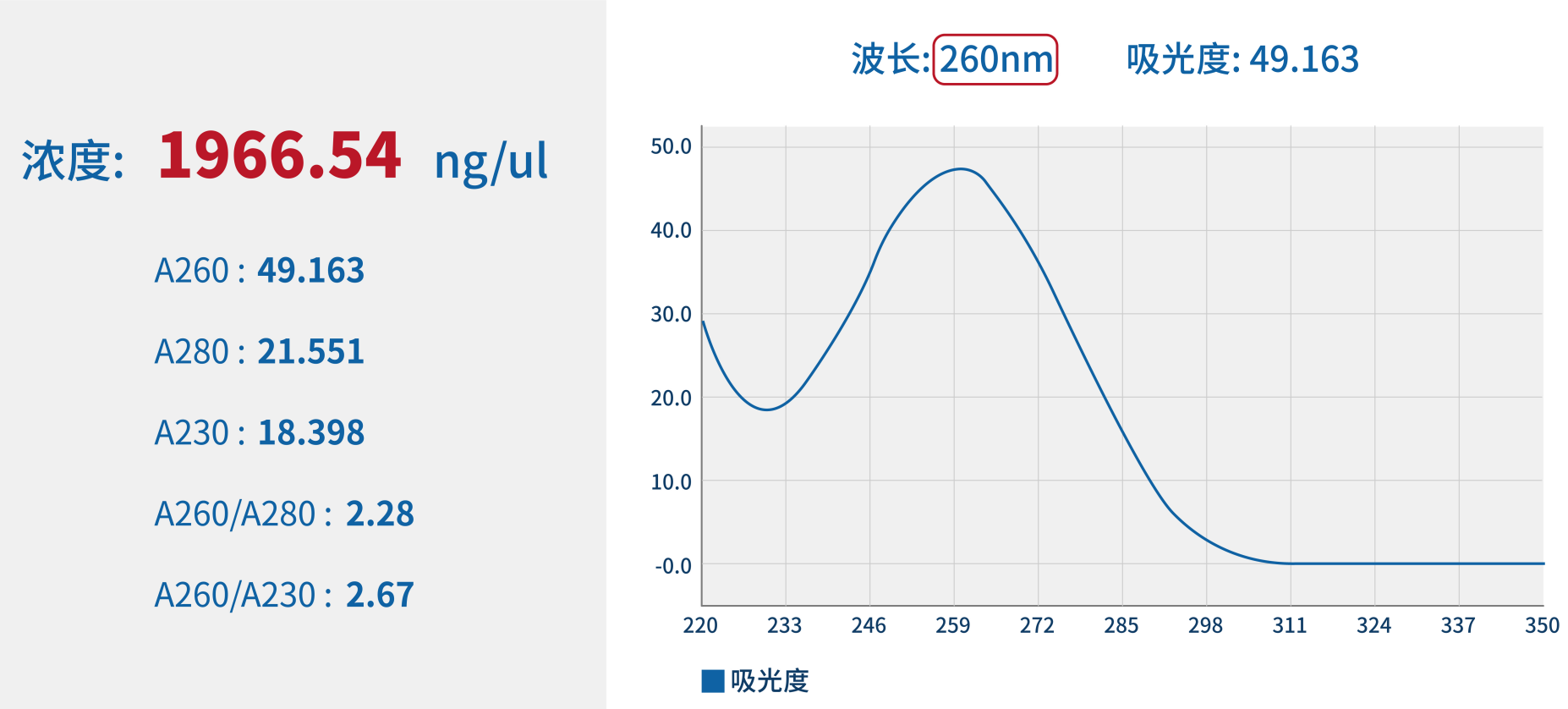 |
Ribogreen | 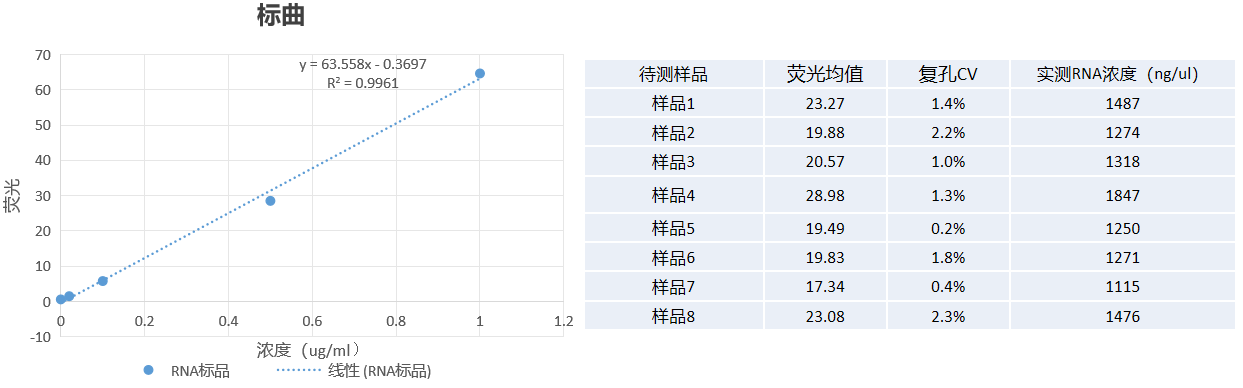 | |
完整性 | CE | 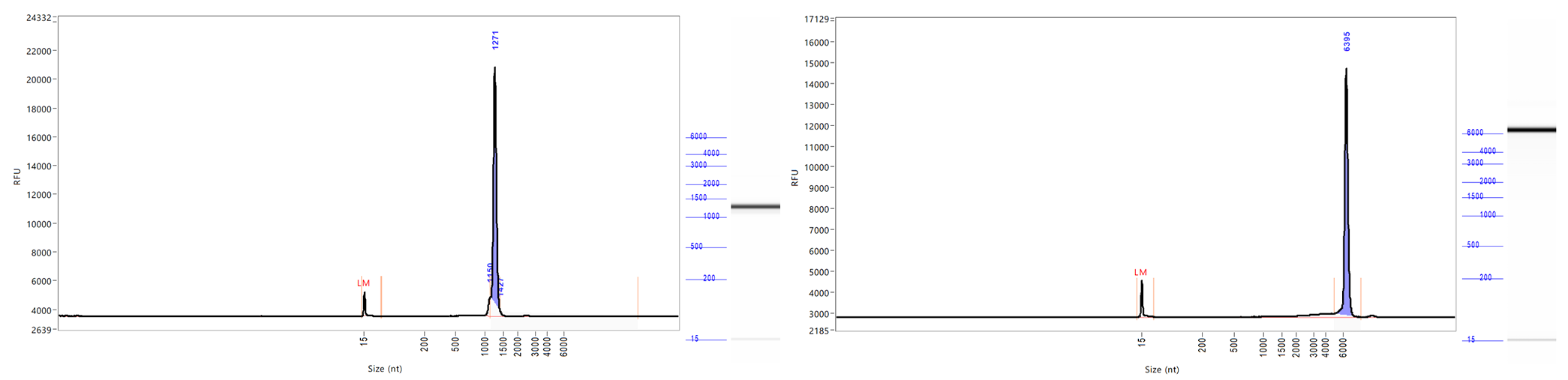 |
SEC-HPLC | 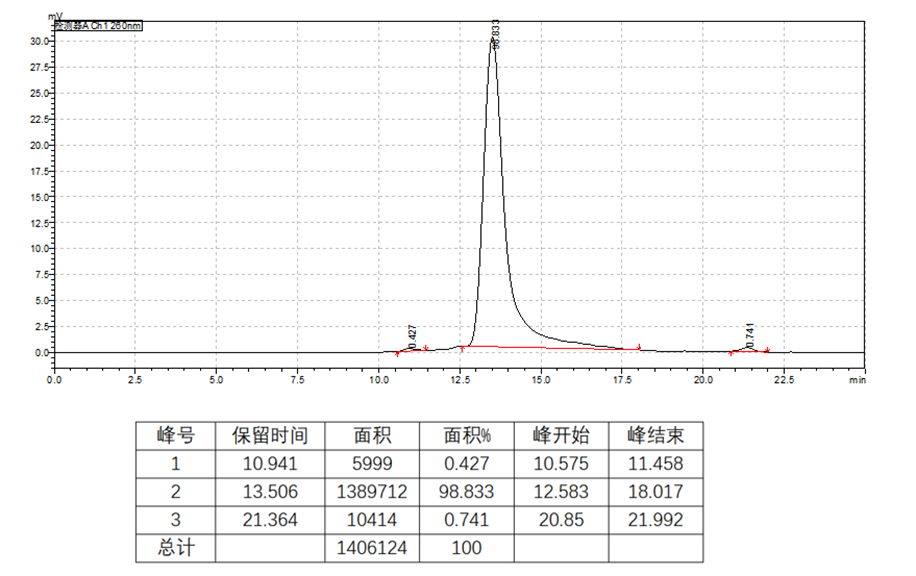 | |
DNA模板残留 | qPCR | 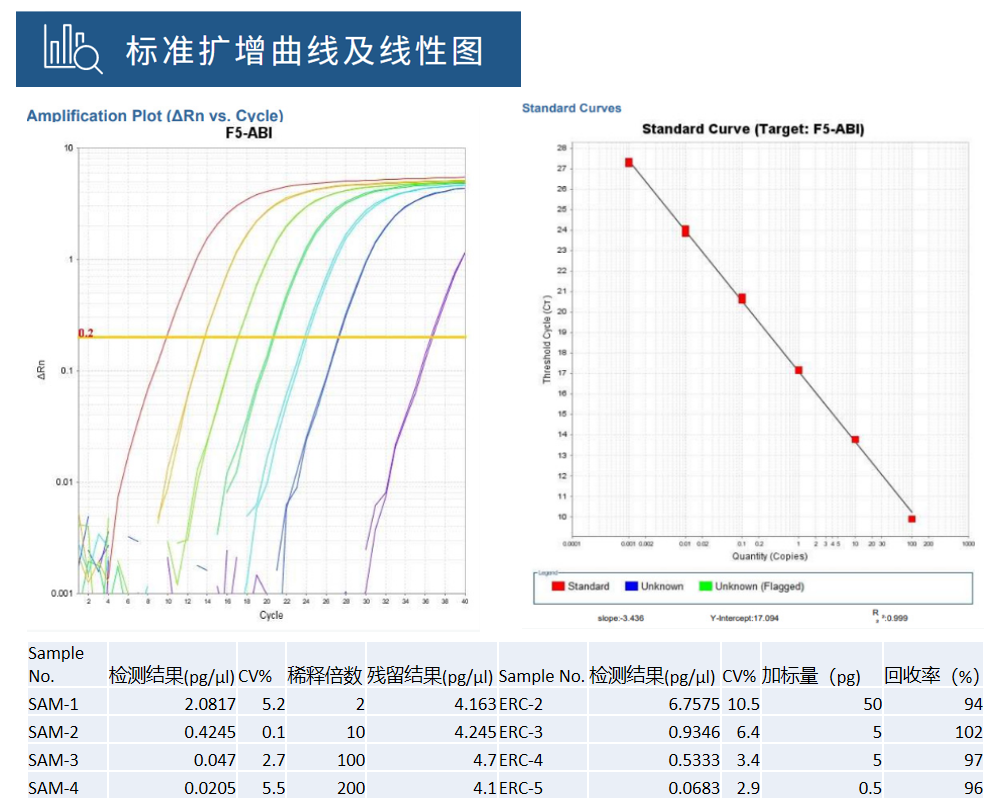 |
加帽率 | LC-MS | 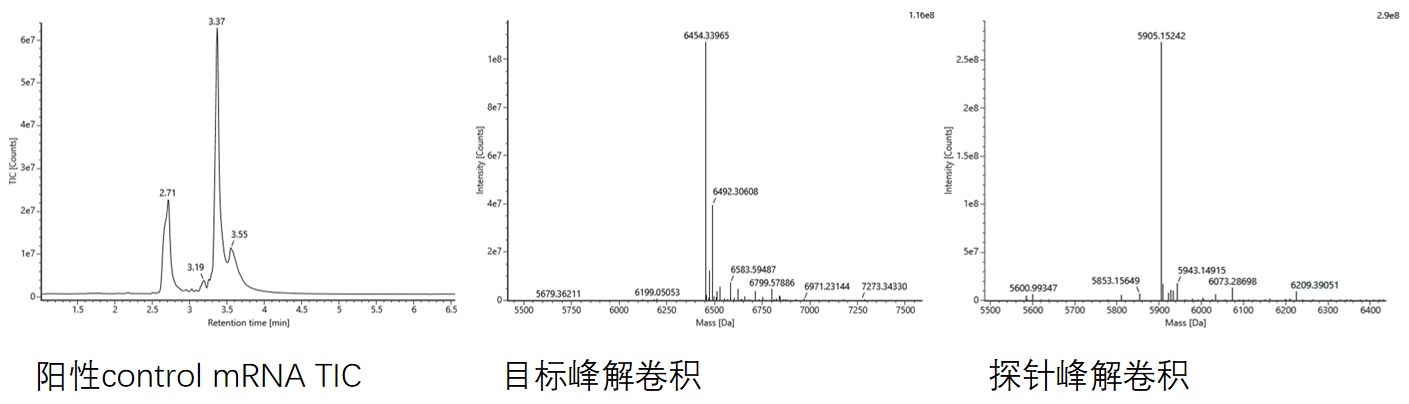 |
加尾分布 | LC-MS | 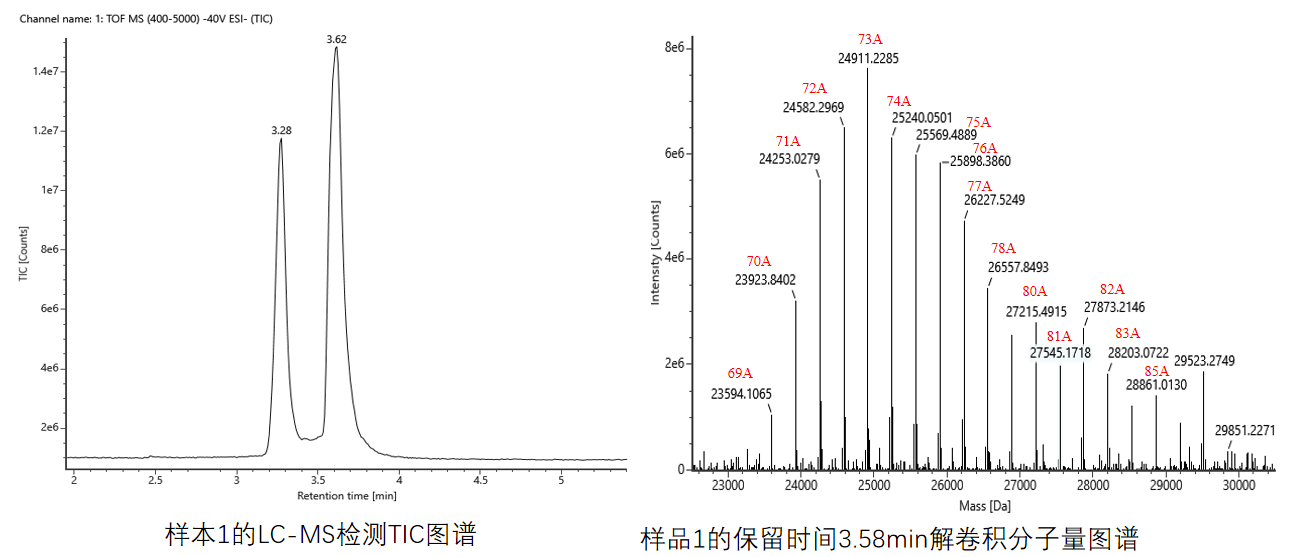 |
总蛋白残留 | Nanoorange | 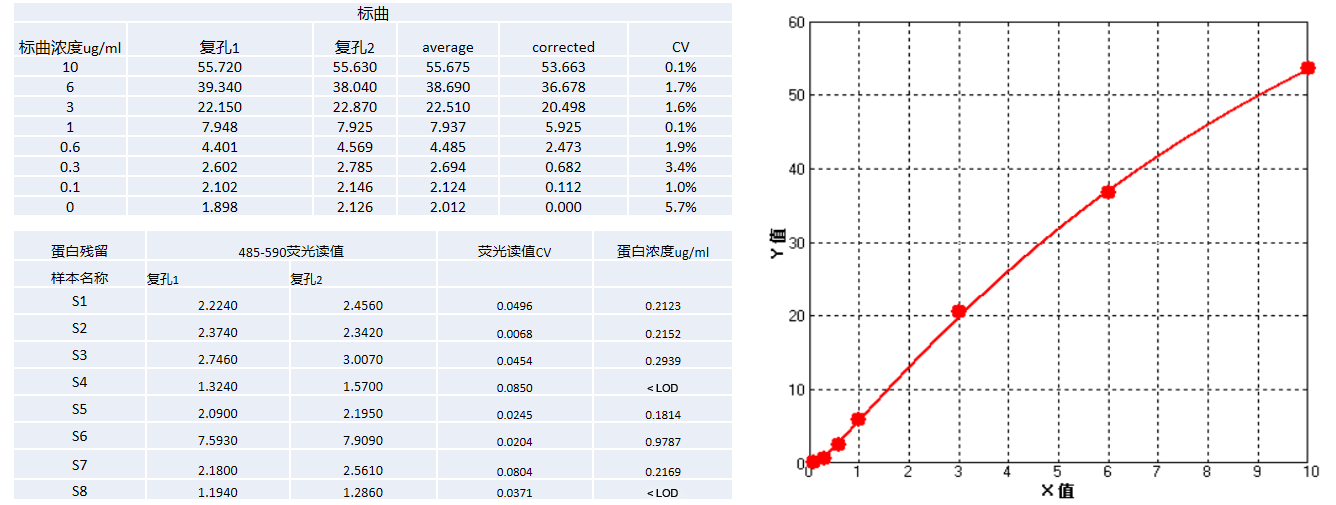 |
产品相关杂质——NTP残留 | SEC-HPLC | 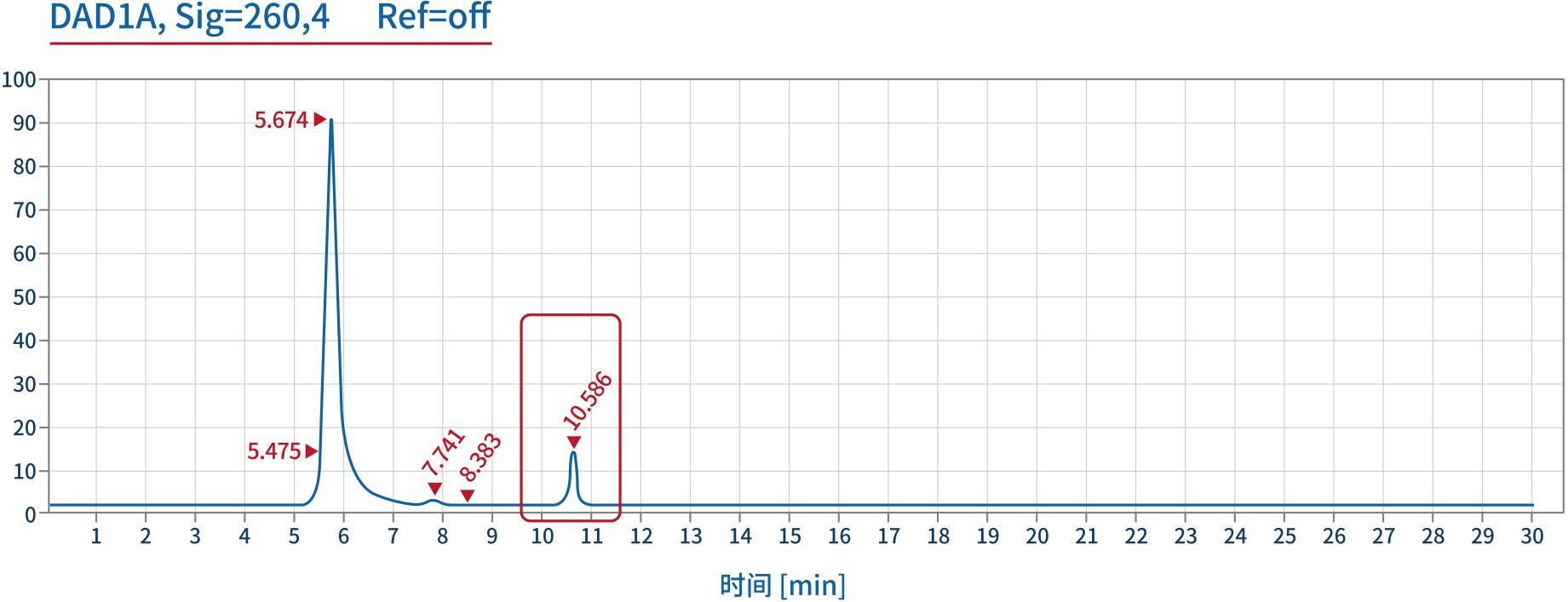 |
产品相关杂质——聚体定量 | SEC-HPLC | 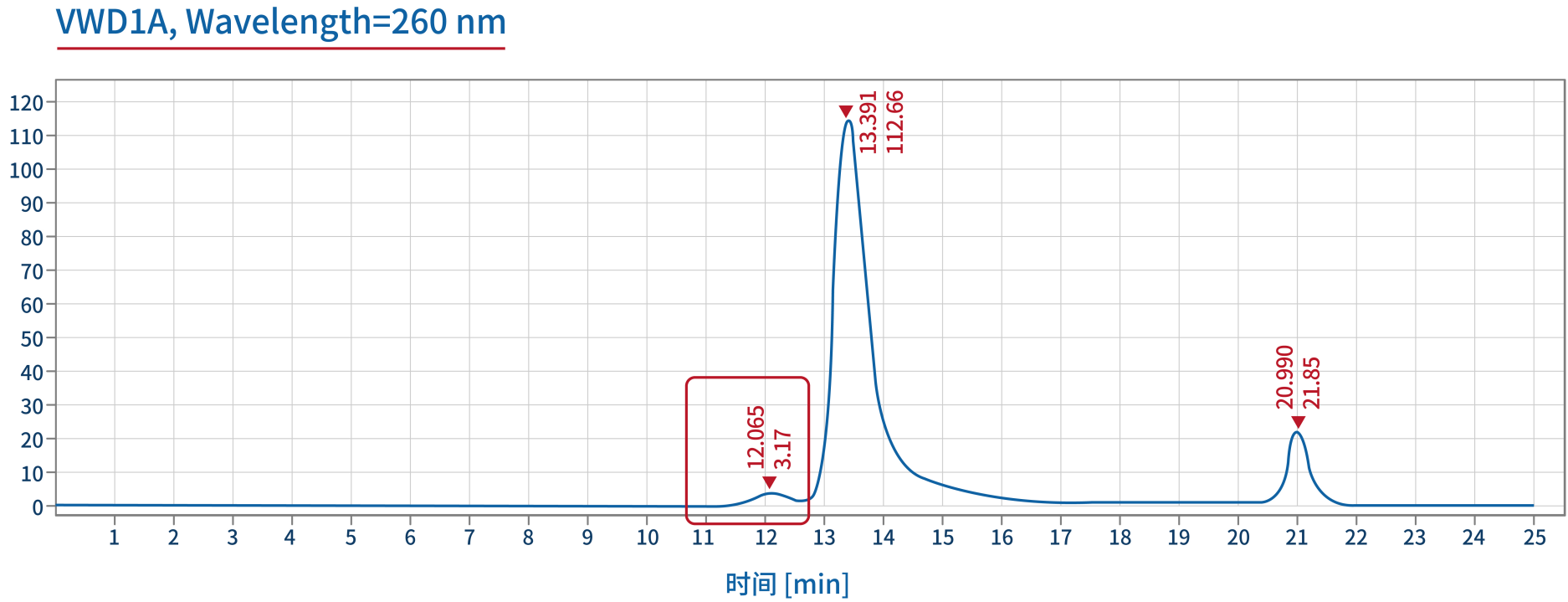 |
产品相关杂质——残留T7 RNA聚合酶含量 | ELISA | 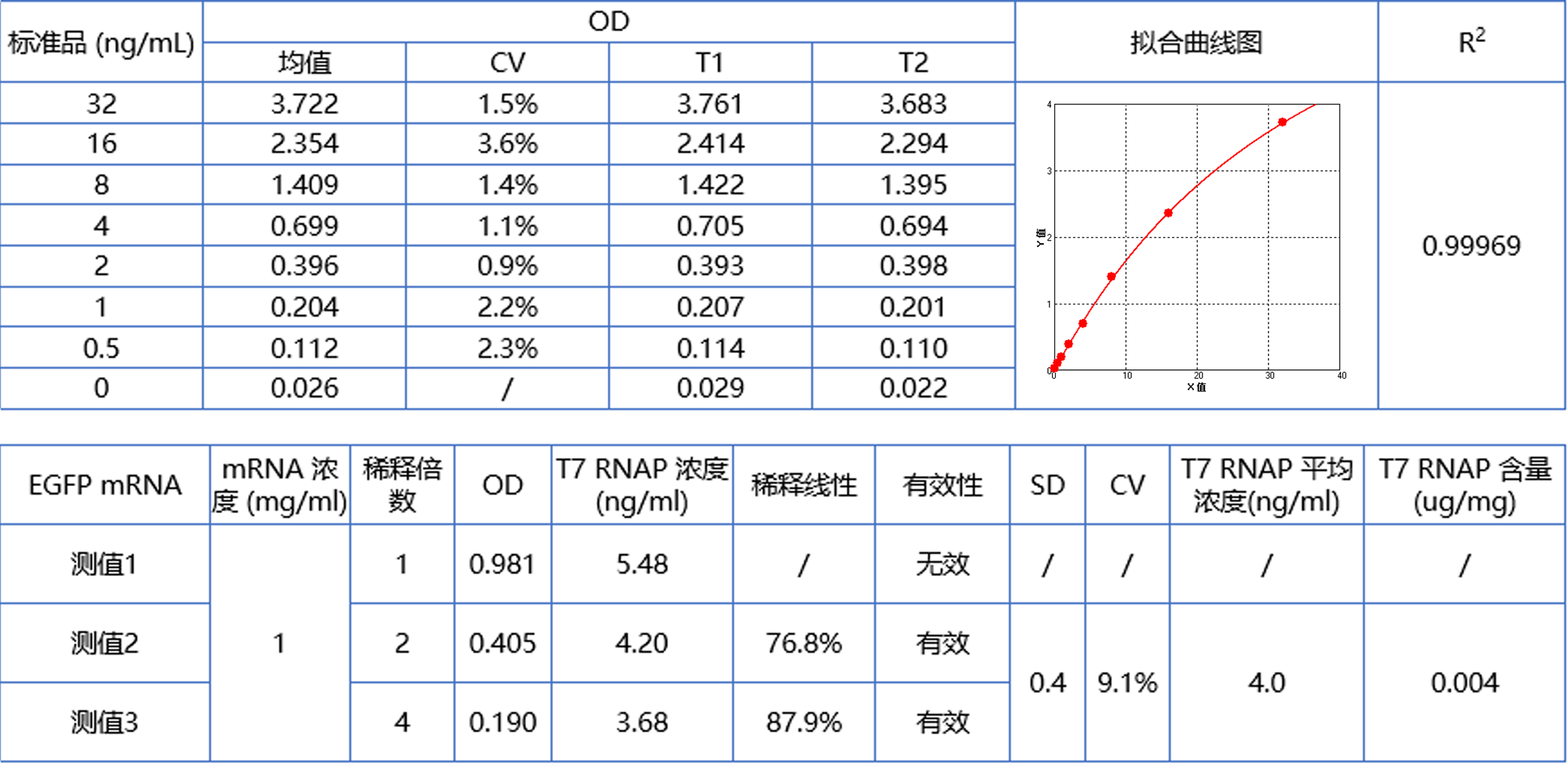 |
内毒素 | 重组C因子/鲎试剂 | 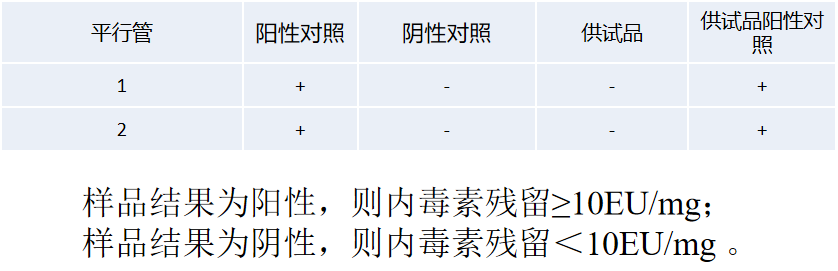 |
验证水平 | 检测方法 | 周期 | 结果展示 |
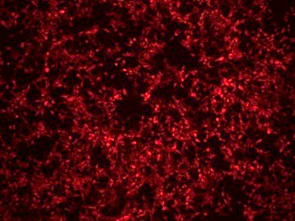
细胞内表达水平验证 | 荧光显微检测 | 3天 | 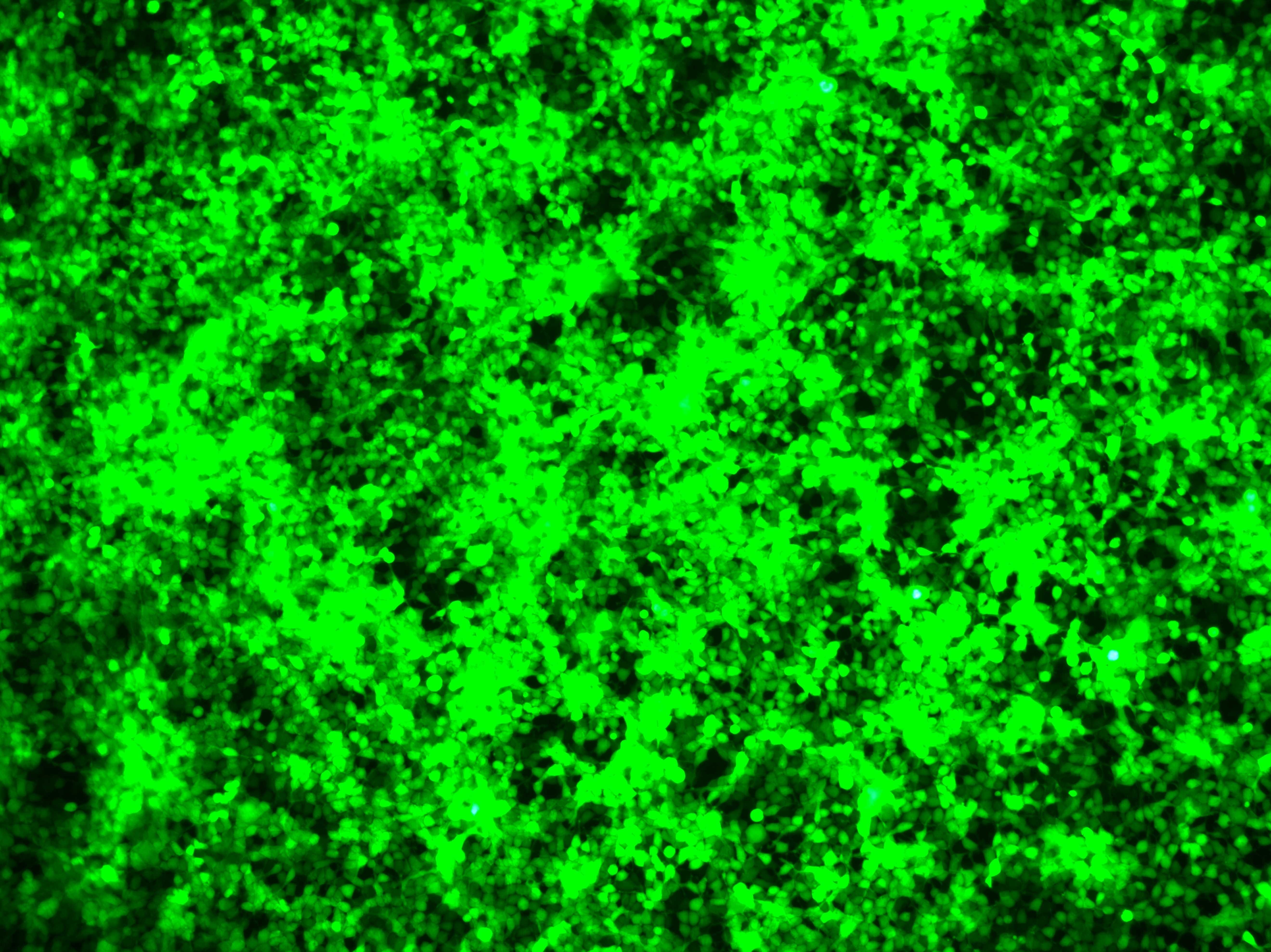 |
流式分析 | 3天 | 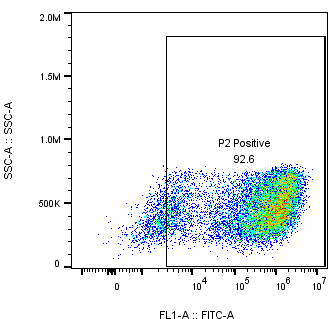 | |
萤火虫萤光素酶的检测 | 3天 | 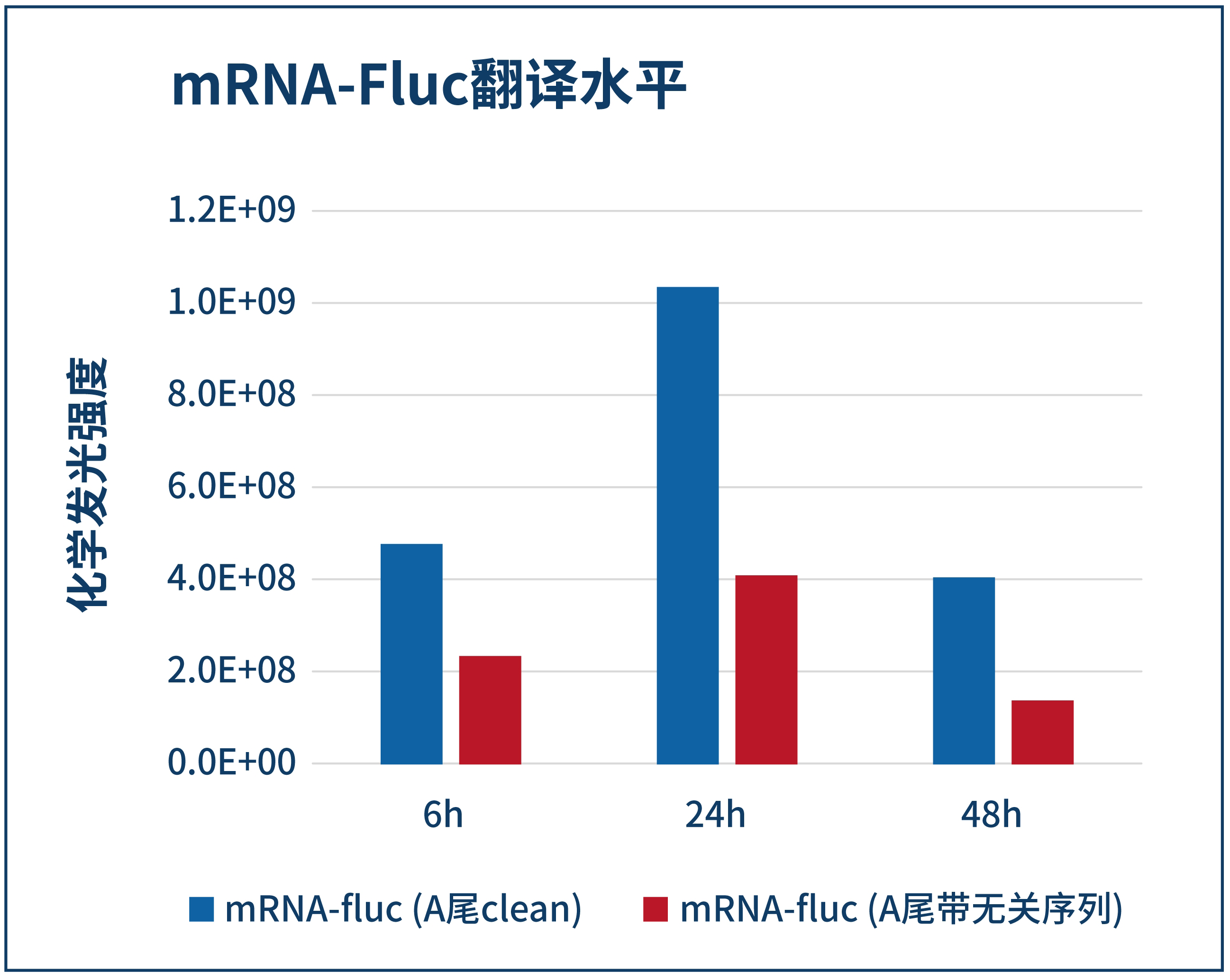 | |
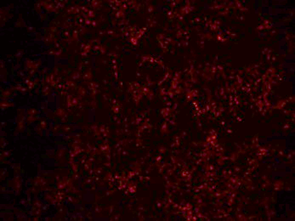
免疫荧光IF | 3天 | 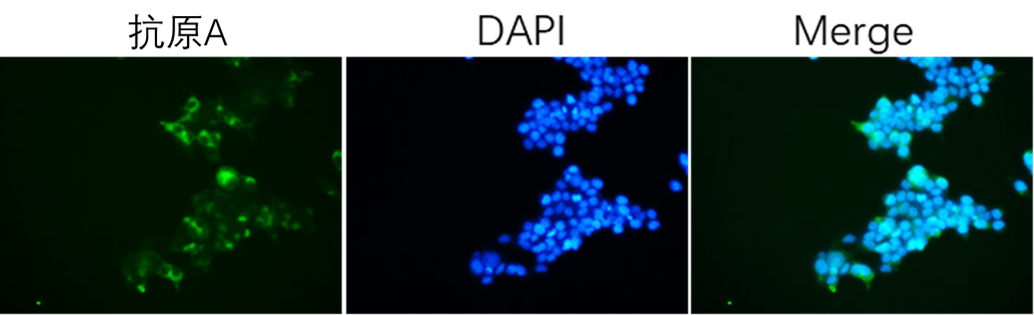 | |
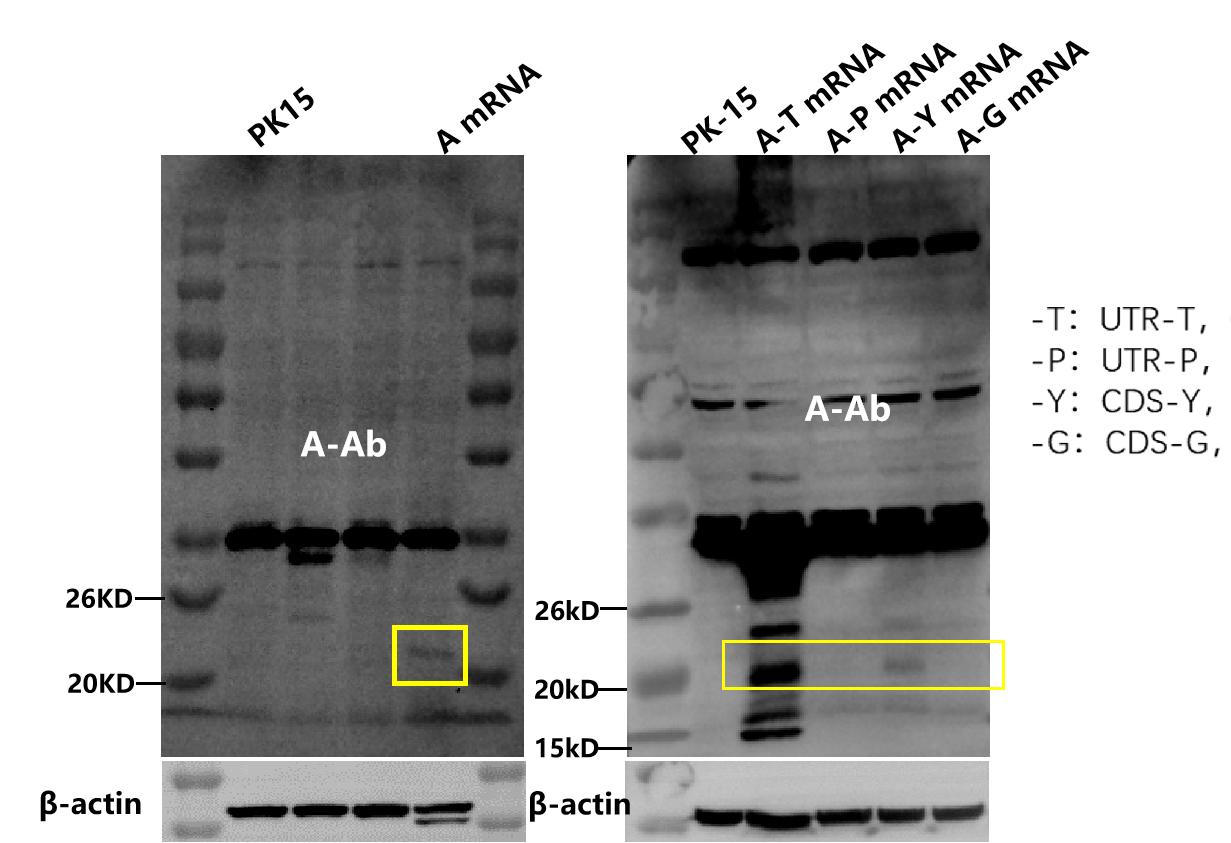
WB | 3天 | 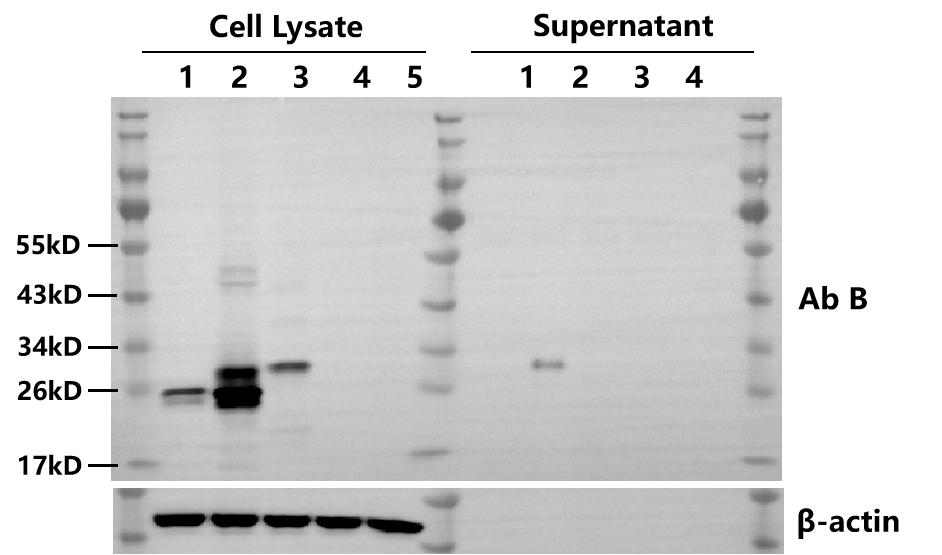 | |
ELISA | 3天 | 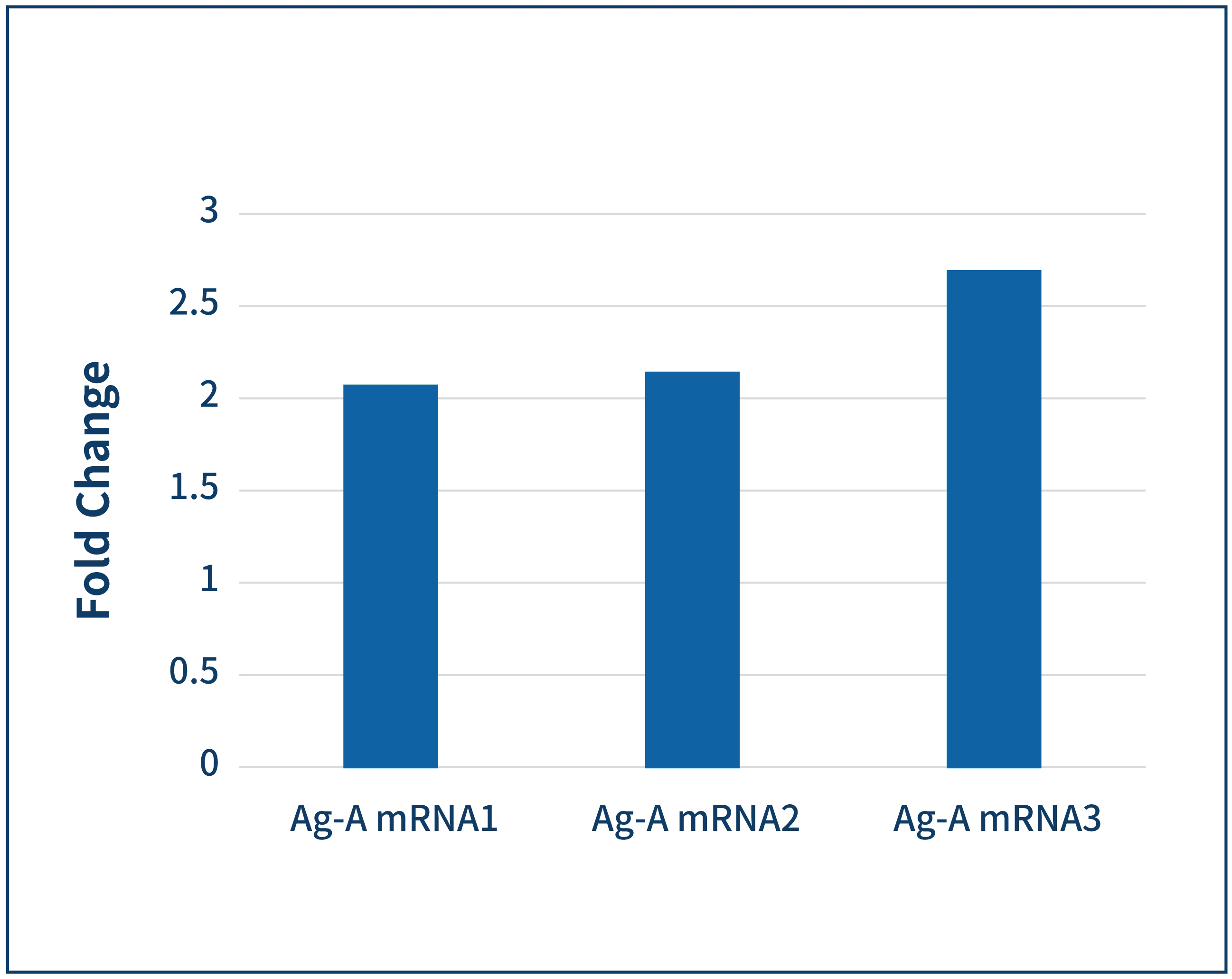 | |
体内表达水平验证 | 体内活体成像 | 1~2天 | 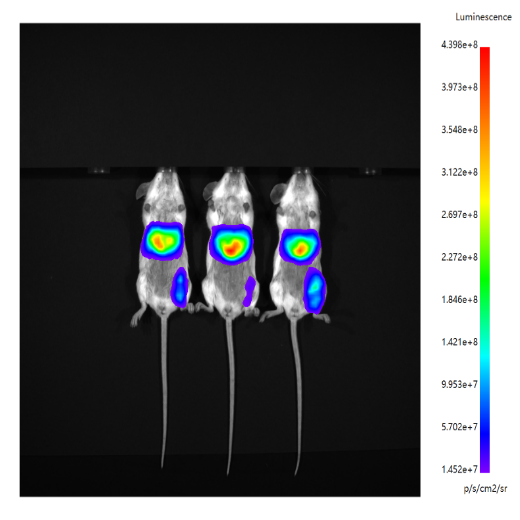 |
血清蛋白表达检测 | 2天 | 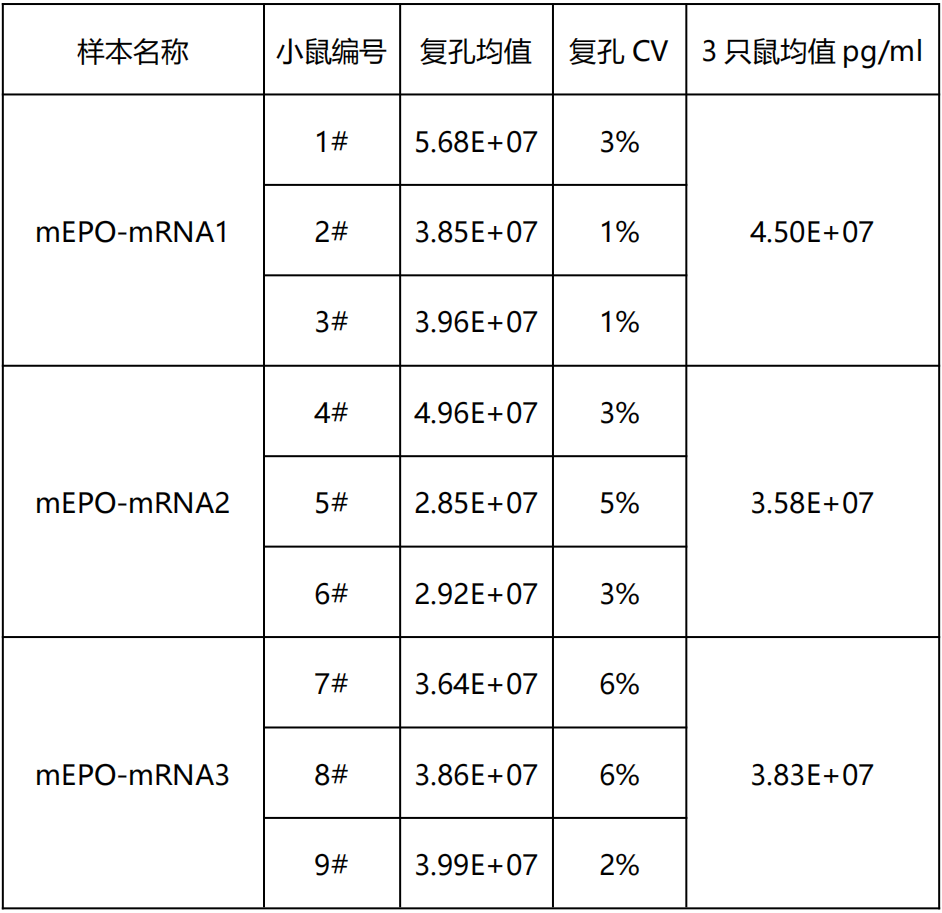 |

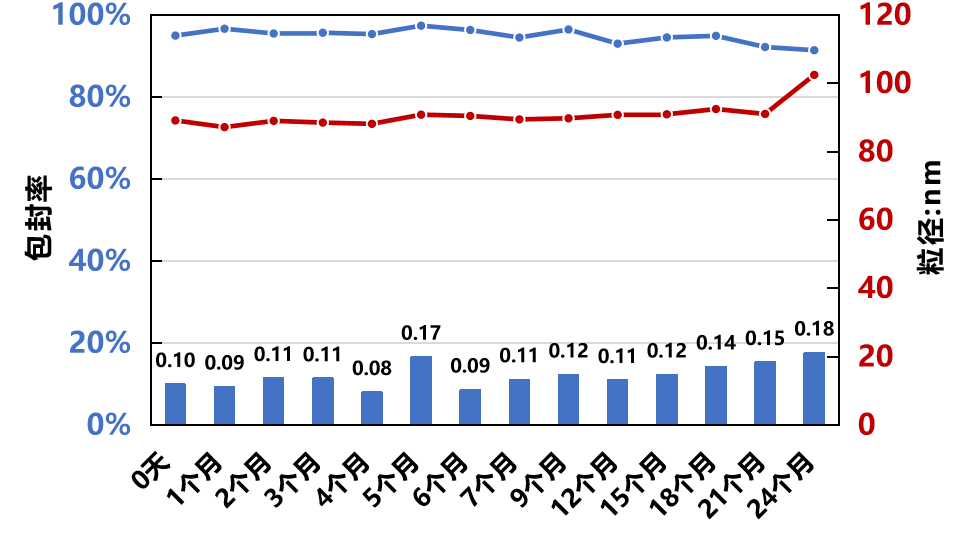
产品放行检测
质检项 | 质检方法 | 结果展示 |
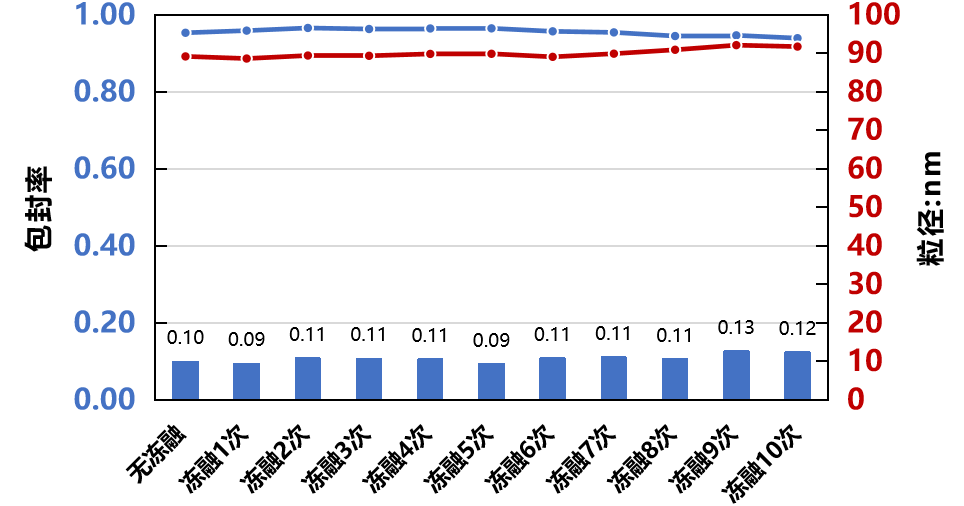
包封率 | Ribogreen | 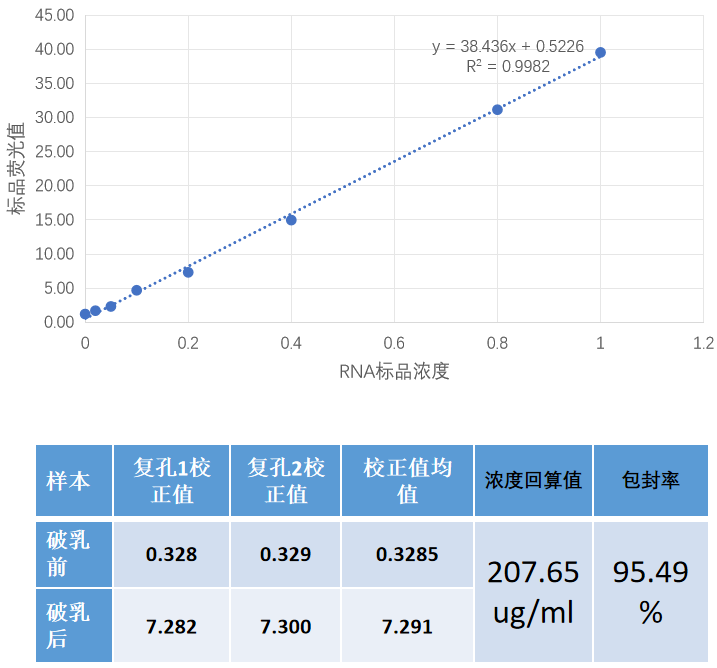 |
制剂RNA浓度 | ||
PDI/粒径 | DLS | 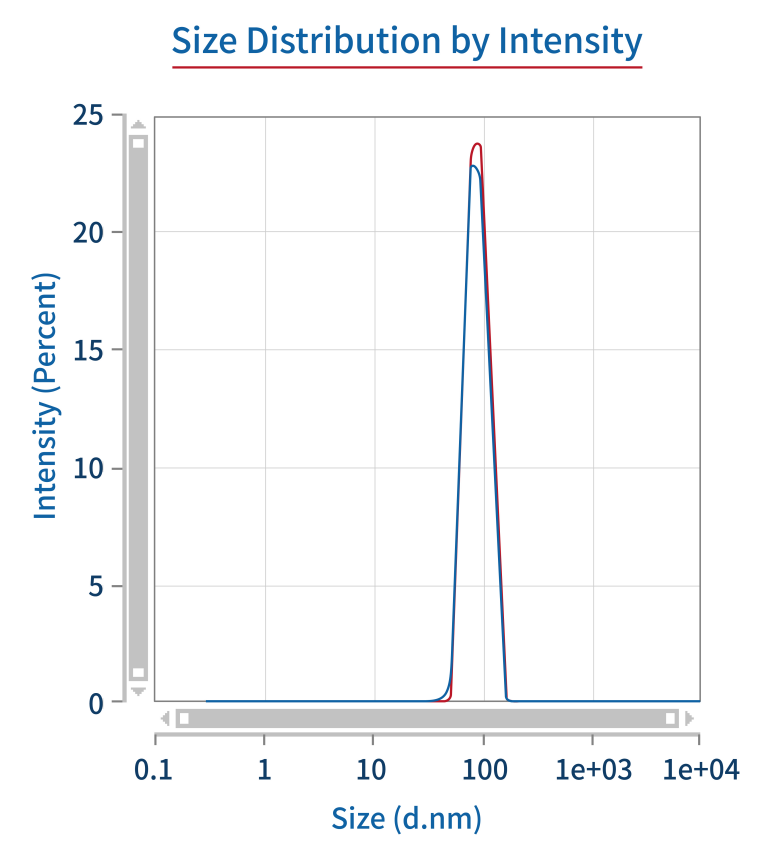 |
Zeta电位 | 多普勒电泳 | 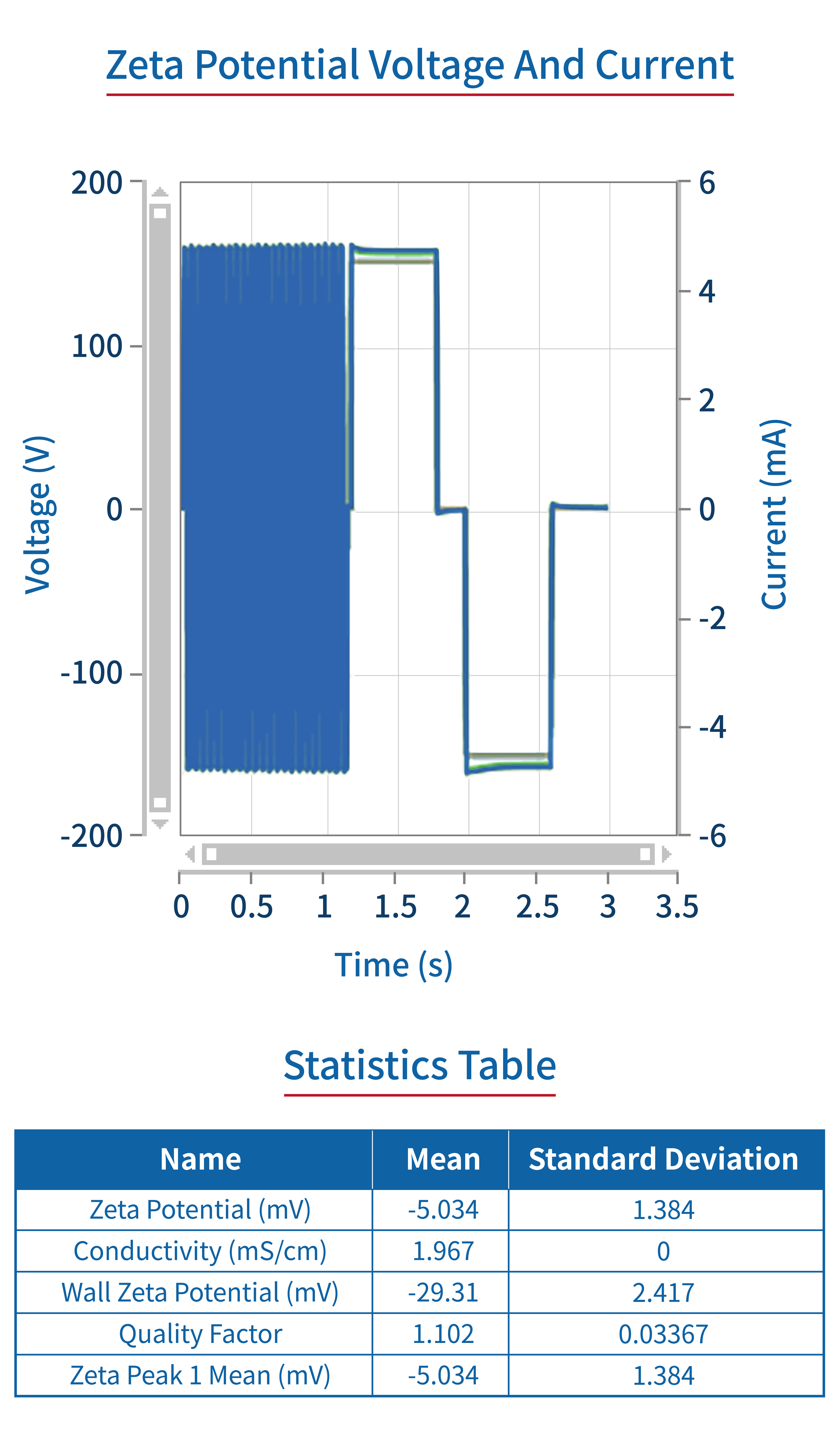 |
多价RNA分子摩尔比 | ddPCR+qPCR | 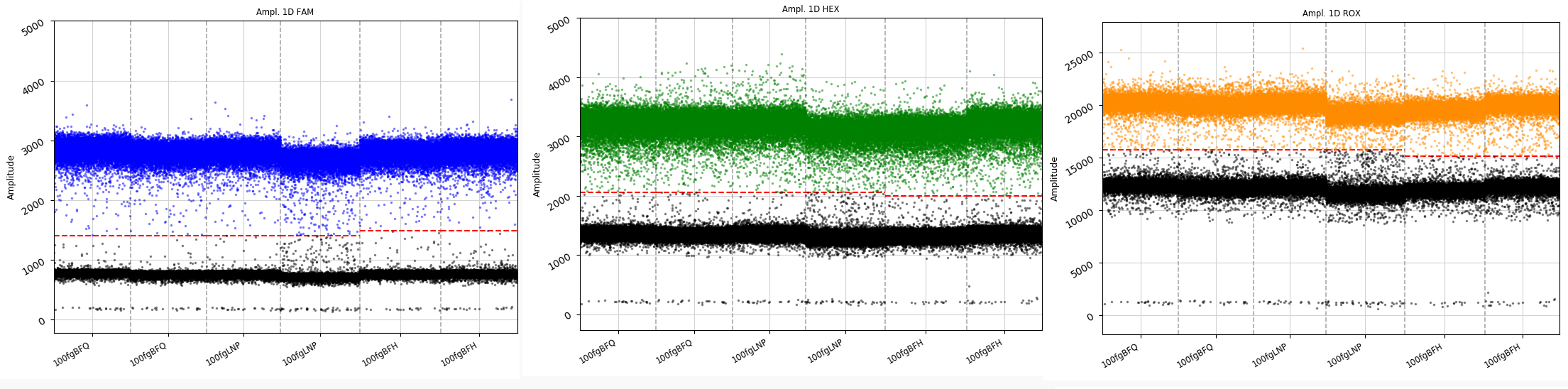 |
RNA序列确认 | sanger测序/RT-PCR | 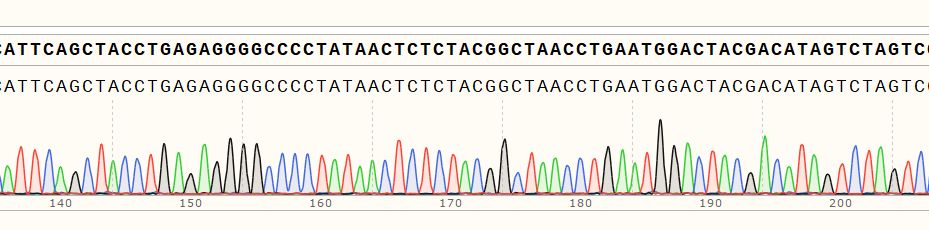 |
脂质含量测定 | ELSD-HPLC | 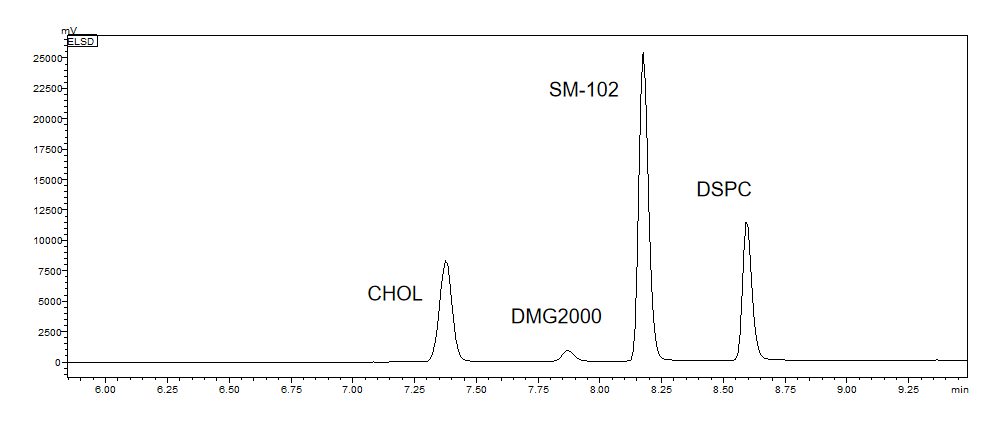 |
RNA完整度 | CE/HPLC | 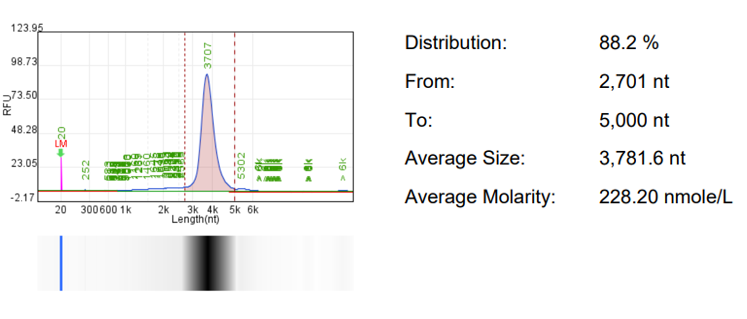 |
内毒素 | 重组c因子/鲎试剂 | 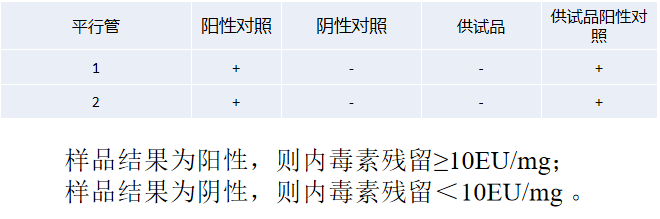 |
蛋白表达验证 | WB/FACS/IF/ELISA |

