解码 LNP:mRNA包封工艺及应用!连载专题第5期上线
20 世纪 60 年代发现脂质在水中能自发形成封闭的脂质双层囊泡,才有了 “脂质体(Liposome)” 一词。随着纳米科学和纳米技术时代的开始,20 世纪 90 年代初期才开始使用 “脂质纳米粒(Lipid nanoparticle,LNP)” 一词。针对 Covid-19 新型冠状病毒的 mRNA 疫苗的幕后功臣就是将 mRNA 封装并且安全有效地送进机体细胞的 LNP。将 mRNA 包裹在 LNP 中,再进入人体,不仅具有低毒性、低免疫原性、优异的动力学稳定性和坚固的结构,还能在全身循环中保护 mRNA 免遭核酸酶的破坏,并通过与早期内体的脂质双分子层的融合机制,高效地将 mRNA 传递至细胞内。是 FDA 唯一批准上市的 mRNA 递送技术,并且已经在世界各地注射上亿剂的 mRNA 新冠疫苗中采用,其技术的安全性和有效性已经在这次全球的新冠疫情中得到验证。
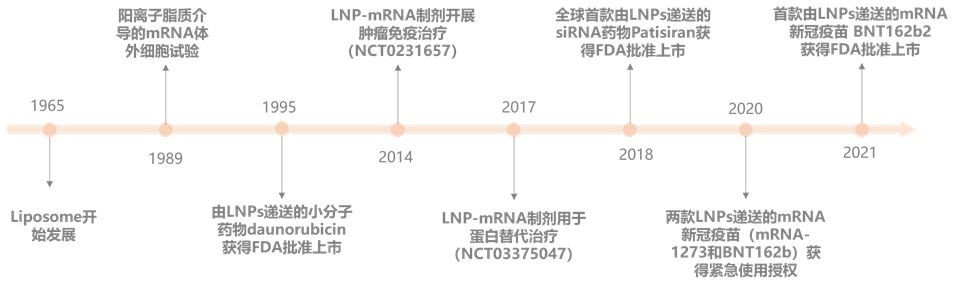
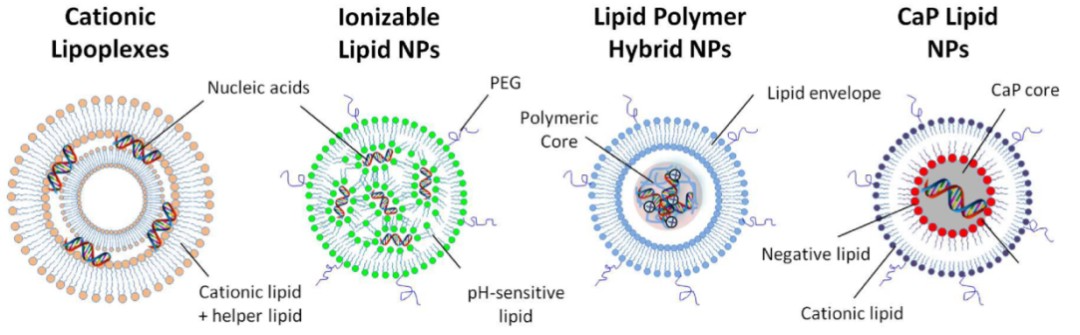
根据脂质纳米粒结构和载药机制的不同,LNP 可分为:阳离子LNP(Cationic LNP)、脂质聚合物杂化纳米粒子(Lipid Polymer Hybrid NPs (LPHNPs))、磷酸钙(CaP)LNP(Lipid Calcium Phosphate NPs (LCP))和可电离LNP(Ionizable LNPs)等[1]。
LNP的类型
01
阳离子 LNP 是首批用于基因递送的合成材料之一[2],由阳离子脂质和中性辅助脂质组成,阳离子脂质体具有强烈结合并浓缩带负电荷的核酸进入稳定纳米颗粒的能力,这些纳米粒被称为 LPX(lipoplexes)。这种 LPX 在体外非常有效,但在水溶液中不稳定,并且由于它们在体内循环中的半衰期短,因此在体内递送的效率有限。
LPHNPs 由核酸与脂质和阳离子聚合物共同浓缩而成。该系统结合了阳离子脂质和聚合物在基因递送中的优势。多聚阳离子减少了使用的阳离子脂质量,并改善了 DNA 的核递送[3]。外层的脂质层为核酸提供了更多的保护,并且可以通过不同的配体和装置进行修饰,以改善药代动力学和特定细胞的靶向性[1]。
LCP NP 是最一种多功能平台,用于递送各种核酸。核酸与磷酸钙(CaP)结合形成核心,然后包被不同的脂质,形成被称为 LCP-1 的核-壳结构。LCP 纳米粒的特点是直径较小,小于 50nm,这有助于通过肝脏的肝窦窗孔实现肝细胞递送[4]。
可电离脂质 LNP 通常由四种成分组成:可电离脂质、磷脂、胆固醇和聚乙二醇(PEG)脂质。其中可电离脂质是 LNP 递送系统中最关键的辅料,在决定 mRNA 递送和转染效率方面尤为重要,可电离阳离子脂质的 pKa 小于 7,因此在酸性介质中带正电,在生理条件下呈电中性。可在酸性条件(pH=4)下使其与核酸相互作用并包裹,再通过改变缓冲体系使 pH=7.4,形成中性的 LNP,不仅适合系统给药,还避免了永久正电荷 LNP 的缺点[5];PEG 脂质对调节粒径和 Zeta 电位有显著影响,可通过减少颗粒聚集来促进颗粒稳定,还能够防止血清蛋白与纳米粒子结合,减少纳米粒子在全身循环中的清除,从而延长全身循环时间;磷脂通常是中性的,可为LNP提供双层结构稳定性,同时可提高细胞膜的通透性,促进细胞摄取和内体逃逸;胆固醇通过调节膜的完整性和刚性来提高颗粒稳定性[6]。
可电离脂质 LNP 具备两大额外优势,首先,能与循环中的内源性蛋白,如载脂蛋白E(ApoE)结合,该蛋白通过低密度脂蛋白(LDL)受体途径有效地介导可电离脂质 LNP 被传递到肝细胞。其次,在内涵体的酸性 pH 环境中,这些脂质获得正电荷,并能与内涵体膜上的负电荷脂质结合,形成非双层结构,诱导内涵体破裂,从而引起内涵体逃逸。由于这种有效的内涵体逃逸过程,使用可电离脂质进行 siRNA 和 mRNA 递送在体外产生的基因沉默和表达的效果比阳离子脂质要大得多。这些优势使得可电离脂质成为了目前市面上一些 mRNA 疫苗的关键成分,如 Moderna 公司的 Covid-19 新型冠状病毒 mRNA 疫苗采用了自主开发的可电离脂质 SM-102,而辉瑞和 BioNTech 则从 Acuitas 公司获得了一种名为 ALC-0315 的可电离脂质的许可。以下我们将重点探讨可电离脂质的制备工艺。
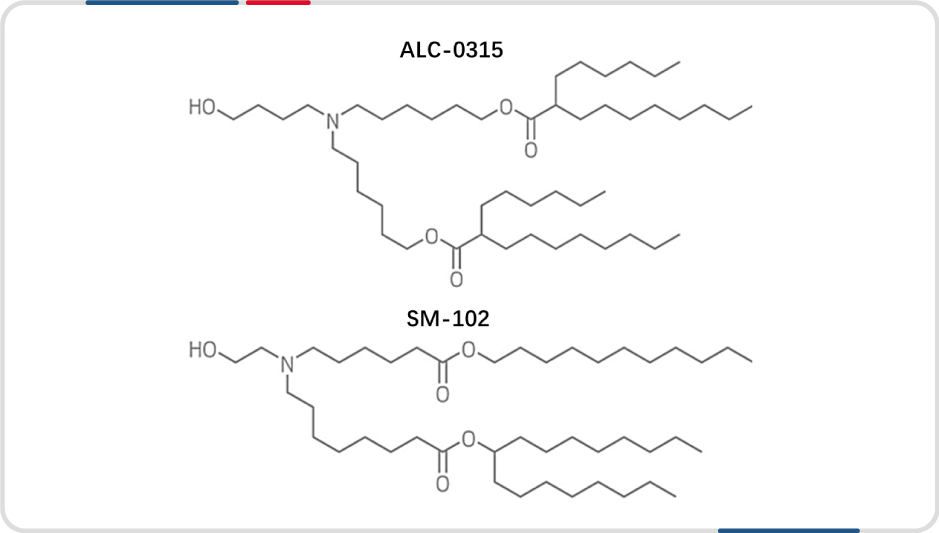
应用与上市mRNA疫苗的两种可电离脂质分子式
LNP 生产过程中关键质量指标有粒径、PDI(polydispersity index)、包封率、Zeta 电位、制剂 mRNA 完整性和递送系统各组分含量等。
LNP 的平均粒径和粒径分布 PDI 是 LNP 质量和各种应用适宜性的重要因素,通常通过动态光散射(DLS)进行表征。研究表明,不同粒径的 LNP 在体内的表达部位不同:肌肉给药情况下,LNP 粒径越小,越容易向肝脏迁移呈现出肝靶向,而粒径较大的大多被留在注射部位[7]。此外,LNP 的大小可能会影响 LNP 的内化、生物分布、降解和清除,且不同的应用可能需要不同的粒径大小[8]。一般认为,LNP 的最佳粒径范围为20−200nm,PDI 低于 0.2。
包封率是 mRNA-LNP 的一个非常关键的指标,表示包封在脂质纳米颗粒内的 RNA 占总 RNA 的比例,通常通过荧光染料法进行表征,主要影响药物的递送效率、稳定性、安全性。高包封率 LNP 可以确保更多的药物分子被有效递送至目标细胞,提高治疗效果;在体内外环境中更稳定,从而减少药物在递送过程中的损失;也可以减少暴露在外的药物分子,降低免疫反应和副作用的风险。通常默认合格的 LNP 包封率 >90% [9]。
mRNA 的稳定性和完整性对于其功能的发挥至关重要,LNP 作为 mRNA 的载体,通过特定的技术手段将 mRNA 包裹在其中,以保护 mRNA 不受体内酶的降解,同时帮助 mRNA 有效地进入细胞,如果 mRNA 在 LNP 中发生降解,将会影响其编码蛋白质的能力,进而影响疫苗的免疫效果。因此,LNP 中 mRNA 的完整度参数在质控体系中至关重要,目前业界对 LNP 制剂 mRNA 完整度的要求不尽相同。
LNP Zeta 电位是 LNP 周围的静电电位,它是衡量纳米粒子悬浮液稳定性及其潜在副作用的良好指标,可以通过电泳光散射(ELS)、微电泳等多种技术进行测量。Zeta 电位会影响 LNP 的胶体稳定性、聚集行为、絮凝速率以及与生物膜的相互作用等。Zeta 电位绝对值越高,表明 LNP 具有更高的静电斥力和更好的稳定性,而中性的 Zeta 电位会导致 LNP 团聚和潜在的凝聚。
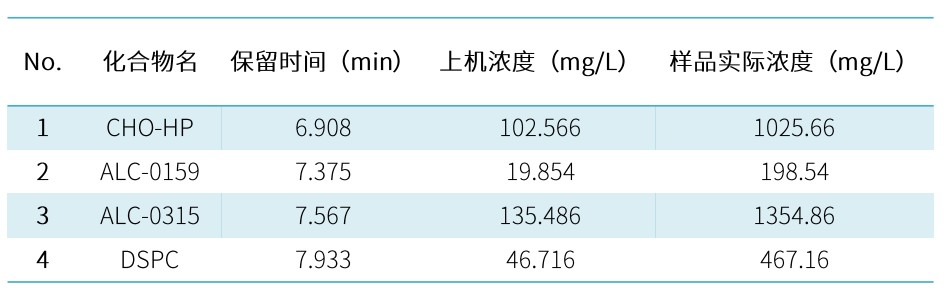
USP《mRNA 疫苗质量分析流程》草案指出,需要对 mRNA 疫苗的 LNP 脂质组分和含量进行测定。为满足 mRNA-LNP 的方法开发和检测需求,瀚海新酶建立了适用的 ELSD-HPLC 分析方法,LNP 四种组分均有较强保留,实现完全分离,成功实现脂质组分的鉴别。
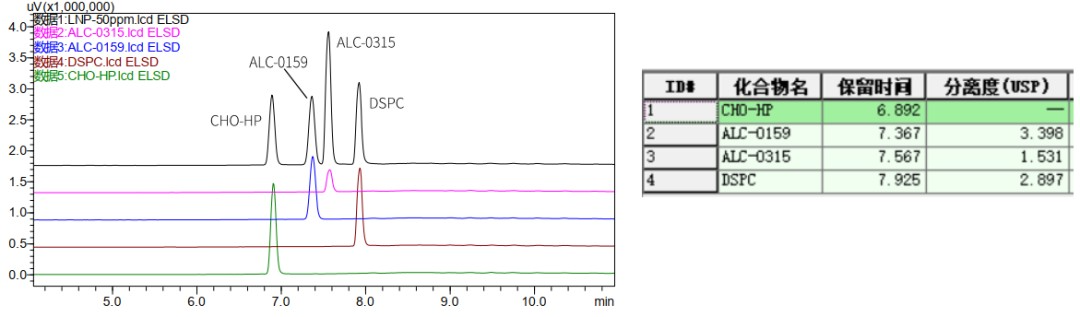
将一定浓度的标准溶液分别进样 10ul 和 5ul,建立标准曲线,将未知样品稀释 10 倍后进样分析,定量结果如下:
常用的脂质纳米粒制备方法主要有薄膜水化法、挤出法、均质法、宏观流体学/T junctions 等。但这类方法生产的 LNP 平均粒径相对较大,包裹率较低。目前使用最多的还是微流控混合技术,该方法相对简便快速,条件温和,同时容易实现生产放大。
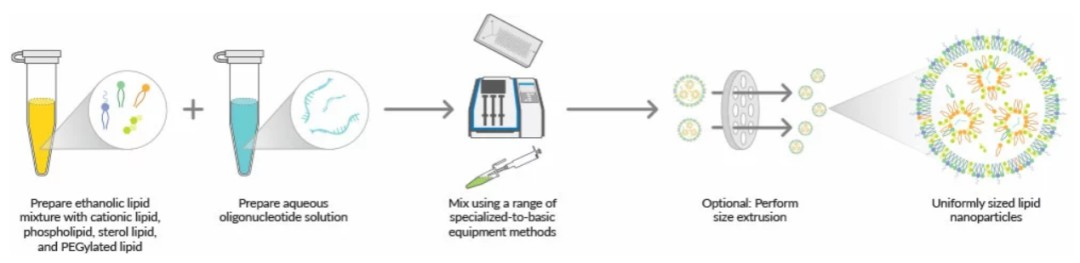
LNP微流控制备工艺
脂质纳米粒制备工艺的优化是一个多因素、多参数的复杂过程,涉及材料选择、工艺参数调整、以及最终产品性能评价等多个方面。
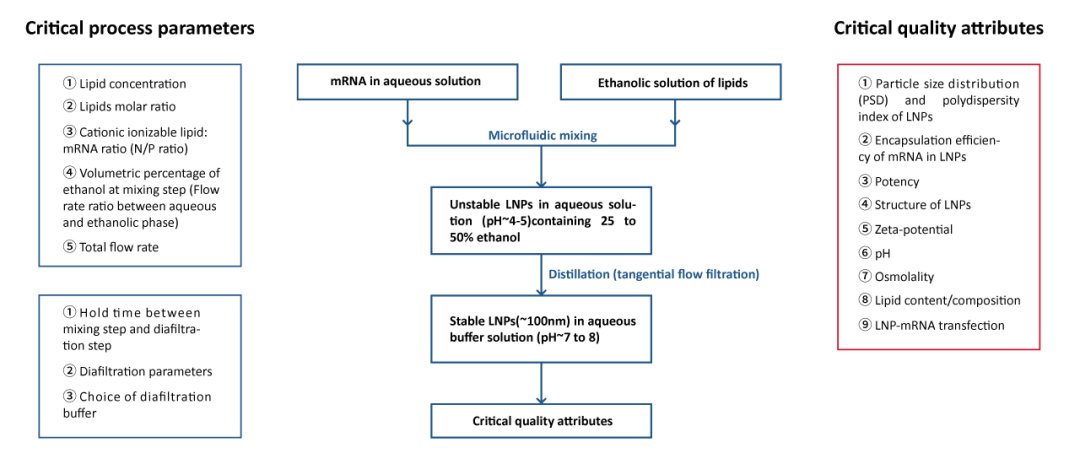
LNP制备流程及工艺过程质量参数
脂质纳米粒制备过程中,各脂质组分的摩尔比决定了 LNP 的组成,并影响其粒径、PDI 和功效。由于 PEG -脂质能够抑制 ApoE 与 LNP 的结合,过量的 PEG-脂质对 LNP 的细胞摄取和转染可能产生不利影响。含有较少 PEG-脂质的 LNP 能够更有效实现核酸递送。两款最早上市的 mRNA 疫苗的 PEG-脂质的占比分别为 1.5% 和 1.6%。

部分上市疫苗各组分摩尔比及氮磷比
已有研究表明[10][11],水相和脂相的流速比以及水相和脂中的总流速会显著影响 LNP 的粒径。在此基础上,瀚海新酶进一步研究了影响 LNP 的粒径的因素。实验结果表明,PEG%,TFR(Total flow velocity 总流速),FRR(Flow rate ratio 流速比)与粒径成反比;水相盐浓度与粒径成正比;而 N:P 和水相 pH 对粒径影响不大。
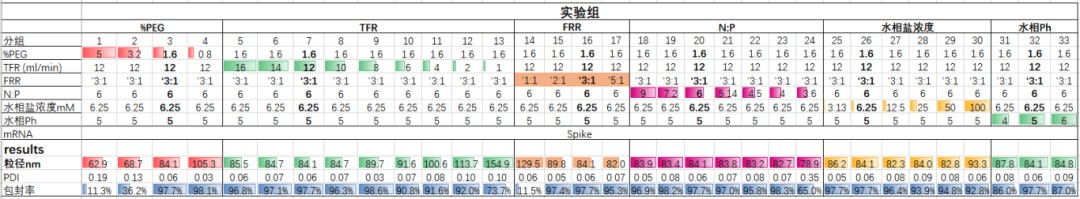
不同工艺参数对LNP理化性质的影响
瀚海新酶针对 LNP 的下游纯化工艺进行了探索和优化,主要针对进口流速、跨膜压差 TMP(Trans-Membrane Pressure Drop)、膜孔径、膜面积、膜材质、中空纤维和平板膜包进行开发,工艺时间可控制在 3.5h 左右,mRNA-LNP 制剂的-80℃ 的稳定性可达 18 个月以上,可冻融 10 次不影响理化指标。
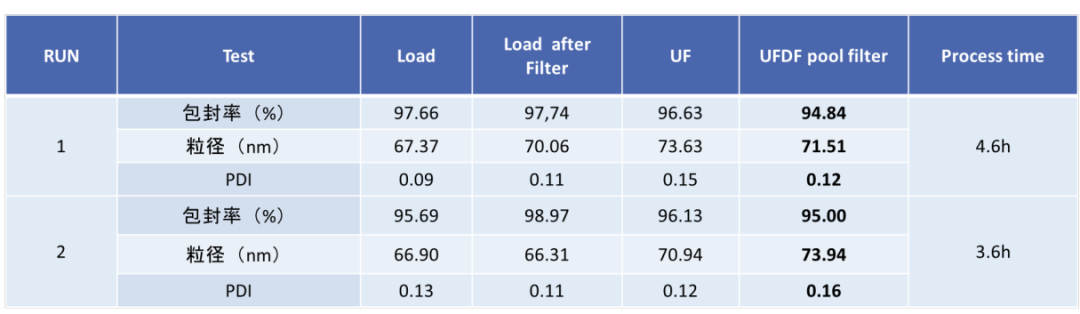
百毫克级mRNA-LNP制剂纯化
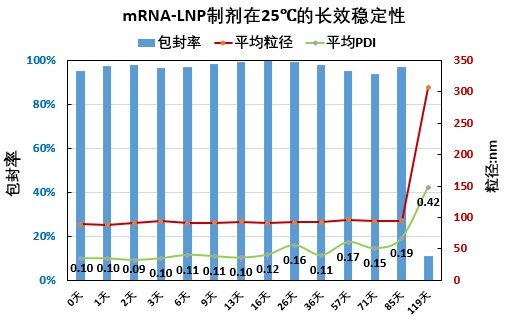
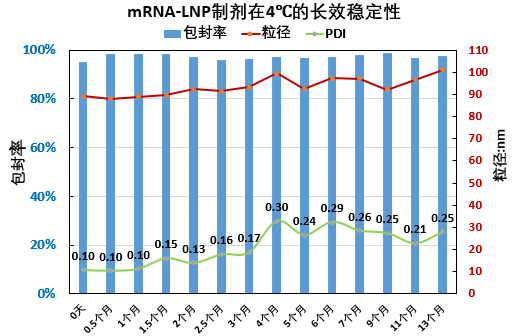
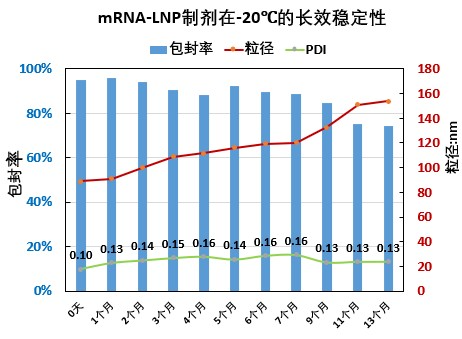
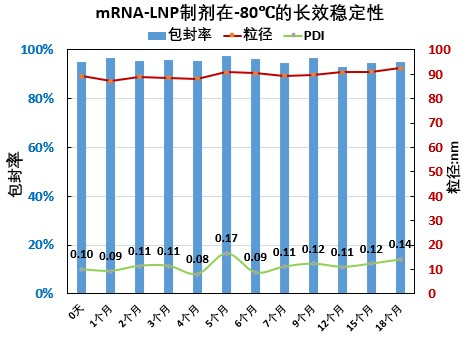
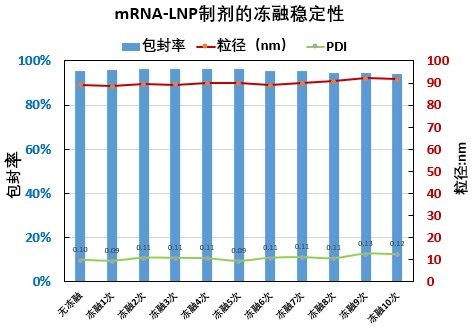
瀚海新酶在 mRNA 生产和 LNP 制备方面,拥有先进技术和丰富经验,采用简洁快速,高稳定性、高质量的微流控技术进行mRNA-LNP 的制备,可提供不同规格的高产量、高纯度、高性价比的 mRNA 和 mRNA-LNP 的定制化服务,可根据客户需求定制不同粒径大小的 LNP,同时提供 mRNA-LNP 的包封率、粒径、PDI、Zeta 电位等相关质量控制检测服务。
基于传统的 LNP 制备工艺繁琐,需要各类设备,导致早研或科研阶段应用成本高,通量收到极大的限制。为助力客户在早研或科研阶段快速靶点验证,瀚海新酶近期推出重磅 LNP 快速包封试剂盒(Fast LNP (in vivo-系统递送)
全套 mRNA 疫苗&药物相关高性能酶原料、化学底物、IVT 试剂盒及质控试剂盒,拥有自主质粒制备、IVT 工艺开发、mRNA 纯化、LNP包封及相关质检平台,可为客户提供基于原料的全套解决方案,全面的工艺开发服务,助力客户快速推进新药开发。对于早研阶段客户可提供 CRO 服务、概念验证服务、第三方质检服务及各类成品 mRNA 原液产品,编码蛋白涵盖报告基因、靶点蛋白、基因编辑蛋白和抗原蛋白等。
[2] Malone RW, Felgner PL, Verma IM. Cationic liposome-mediated RNA transfection. Proc Natl Acad Sci U S A. 1989 Aug;86(16):6077-81.
[3] Masuda T, Akita H, Harashima H. Evaluation of nuclear transfer and transcription of plasmid DNA condensed with protamine by microinjection: the use of a nuclear transfer score. FEBS Lett. 2005 Apr 11;579(10):2143-8.
[4] Satterlee AB, Huang L. Current and Future Theranostic Applications of the Lipid-Calcium-Phosphate Nanoparticle Platform. Theranostics. 2016 Apr 27;6(7):918-29.
[5] Tam YY, Chen S, Cullis PR. Advances in Lipid Nanoparticles for siRNA Delivery. Pharmaceutics. 2013 Sep 18;5(3):498-507.
[6] Li X, Qi J, Wang J, Hu W, Zhou W, Wang Y, Li T. Nanoparticle technology for mRNA: Delivery strategy, clinical application and developmental landscape. Theranostics. 2024 Jan 1;14(2):738-760.
[7] Di J, Du Z, Wu K, Jin S, Wang X, Li T, Xu Y. Biodistribution and Non-linear Gene Expression of mRNA LNPs Affected by Delivery Route and Particle Size. Pharm Res. 2022 Jan;39(1):105-114.
[8] Eygeris Y, Gupta M, Kim J, Sahay G. Chemistry of Lipid Nanoparticles for RNA Delivery. Acc Chem Res. 2022 Jan 4;55(1):2-12.
[9] Muramatsu H, Lam K, Bajusz C, Laczkó D, Karikó K, Schreiner P, Martin A, Lutwyche P, Heyes J, Pardi N. Lyophilization provides long-term stability for a lipid nanoparticle-formulated, nucleoside-modified mRNA vaccine. Mol Ther. 2022 May 4;30(5):1941-1951.
[10]Roces CB, Lou G, Jain N, Abraham S, Thomas A, Halbert GW, Perrie Y. Manufacturing Considerations for the Development of Lipid Nanoparticles Using Microfluidics. Pharmaceutics. 2020 Nov 15;12(11):1095.
[11] Malburet C, Leclercq L, Cotte JF, Thiebaud J, Bazin E, Garinot M, Cottet H. Taylor Dispersion Analysis to support lipid-nanoparticle formulations for mRNA vaccines. Gene Ther. 2023 May;30(5):421-428.










请先 登录后发表评论 ~