国内首个免疫治疗领域团体标准正式发布!《基于mRNA-LNP技术的(细胞)免疫治疗产品开发指南》
实 时 资 讯
2024年9月3日,由中国食药促进会疫苗及生物制品质量评价与标准专业委员会组织全国30多家企事业单位共同编制的《基于mRNA-LNP技术的(细胞)免疫治疗产品开发指南》(T/FDSA 0055—2024)团体标准正式发布,将于2024年10月3日起实施。
这一重要标准,是我国首个专注于mRNA-LNP技术在免疫治疗领域应用的通用规范,标志着我国在生物医药标准化方面迈出了里程碑式的一步。

来源:中国食品药品企业质量安全促进会官方发布
标准详细规定了基于mRNA-LNP技术开发(细胞)免疫治疗产品的技术路线、制备工艺、检验方法、质控要点、功能验证等方面内容,以及研发生产所需的管理、组织、人员、设施设备及物料等相关要求。为科研机构、生产企业提供了明确的技术指导和产品规范,特别是在不同技术路线的产品设计、质控指标等方面,标准提出了具体要求,旨在推动mRNA-LNP技术的持续优化与创新。
该标准的发布填补了行业空白,不仅为mRNA-LNP技术在免疫治疗领域的深入研究与广泛应用奠定了坚实的基础,还向国内外同行提供了清晰、统一的评价标准和技术指南,有力推进了技术创新与国际间产业合作的深化。
瀚海新酶作为起草单位之一,深度参与本次标准的编制。此次历经多轮专家评审与修订。从2023年12月形成初稿,到根据专家反馈不断进行修改完善,直至2024年7月终稿评审通过,每一步都凝聚了编制组成员的心血与智慧。
以下是此前发布的《基于mRNA-LNP技术的(细胞)免疫治疗产品开发指南》征求意见稿,供参考。

来源:中国食品药品企业质量安全促进会官网
国家药品监督管理局疫苗及生物制品质量监测与评价重点实验室与武汉瀚海新酶生物科技有限公司共同制定了《mRNA 疫苗及药物中 dsRNA 杂质定量检测-ELISA 法》、《生物制品中 DNase 残留检测-核酸荧光底物法》和《生物制品中 RNase 残留检测-核酸荧光底物法》三项团体标准,就 dsRNA 定量检测、DNase 残留检测、RNase 残留检测进行了详细的标准阐述。(点击此处查看原文)
在 mRNA 的制备过程中,T7 RNA 聚合酶以 DNA 为模板进行转录,同时会形成不同长度的 dsRNA(Double-Stranded RNA) 副产物。外源 dsRNA 可被细胞中的 Toll 样受体 (TLR)、维甲酸诱导基因-I(RIG-I) 和黑色素瘤分化相关蛋白 5(MDA5) 识别而激活信号通路,释放 TNF-α 和 IFN-y 等细胞因子,导致炎症反应的发生。dsRNA 一方面让自身免疫系统与翻译系统间的反馈调节从而降低 mRNA 的翻译效率,另一方面 dsRNA 使机体形成记忆免疫,造成药物效力降低。
为监测和控制疫苗中主要杂质的残留量,需要在 mRNA 的生产过程中严格控制dsRNA 的含量。
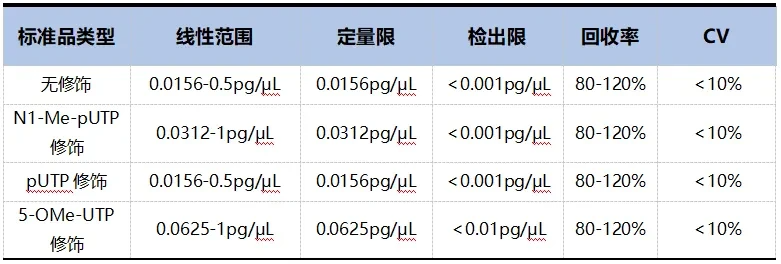
mRNA药物及质粒等生物制品的生产过程中,会存在DNase/RNase的残留和污染的可能性,包括生物样品中含有的内源性DNase/RNase,存在于环境、缓冲液、耗材表面、原料等外源性DNase/RNase。残留DNase/RNase如果跟随生物制品进入人体内,有可能引发高强度的免疫原性等反应,引起较严重的安全性风险。因此需要对生物制品的外来物料、耗材和环境等的DNase/RNase残留进行准确分析检测,使之控制在安全范围内。
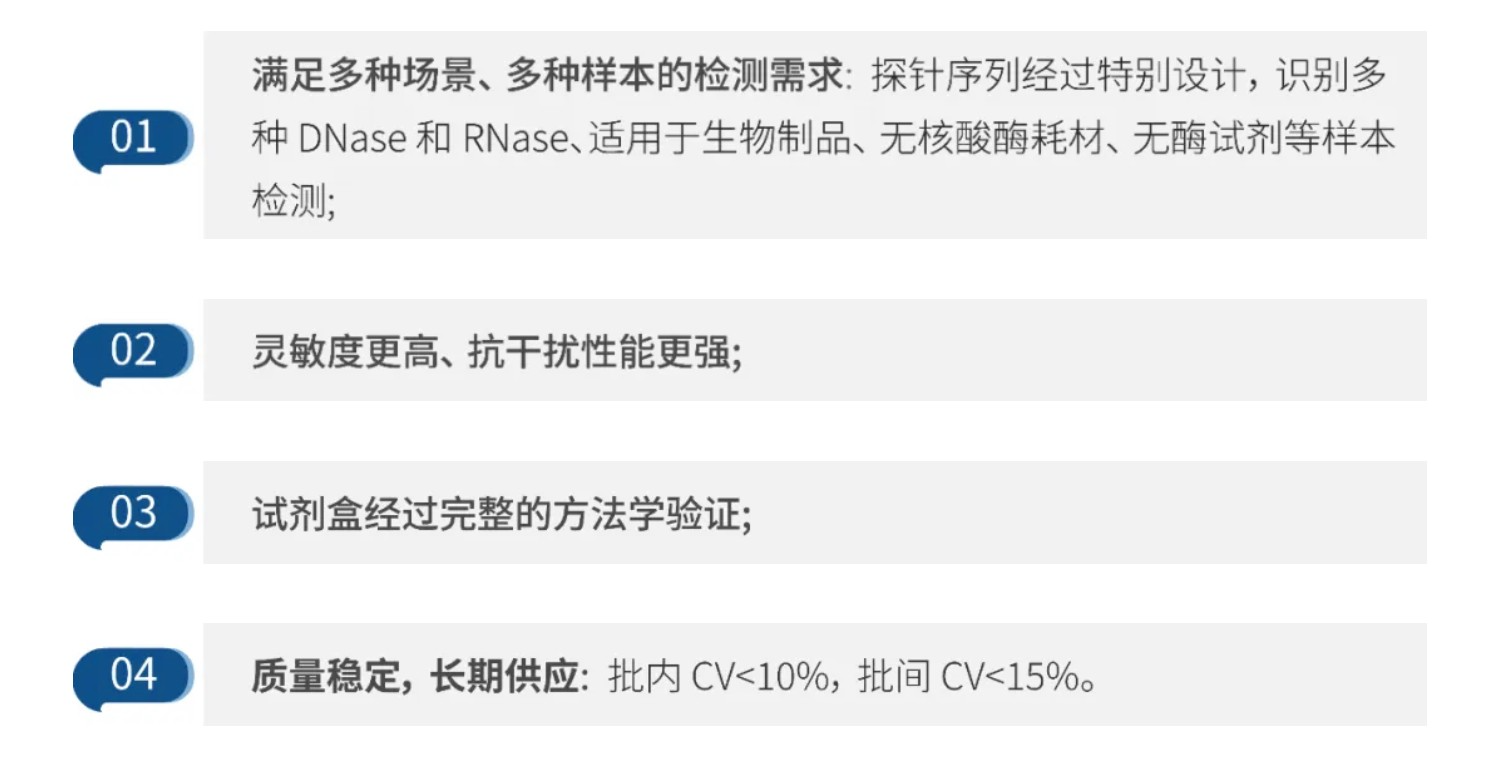
瀚海新酶拥有自主质粒制备、IVT 工艺开发、mRNA 纯化、LNP包封及相关质检平台,可为客户提供基于原料的全套解决方案,全面的工艺开发服务,助力客户快速推进新药开发。
对于早研阶段客户可提供 CRO 服务、概念验证服务、第三方质检服务及各类成品 mRNA 原液产品,编码蛋白涵盖报告基因、靶点蛋白、基因编辑蛋白和抗原蛋白等。并可提供:全套 mRNA 疫苗&药物相关高性能酶原料、化学底物、IVT 试剂盒及质控试剂盒。
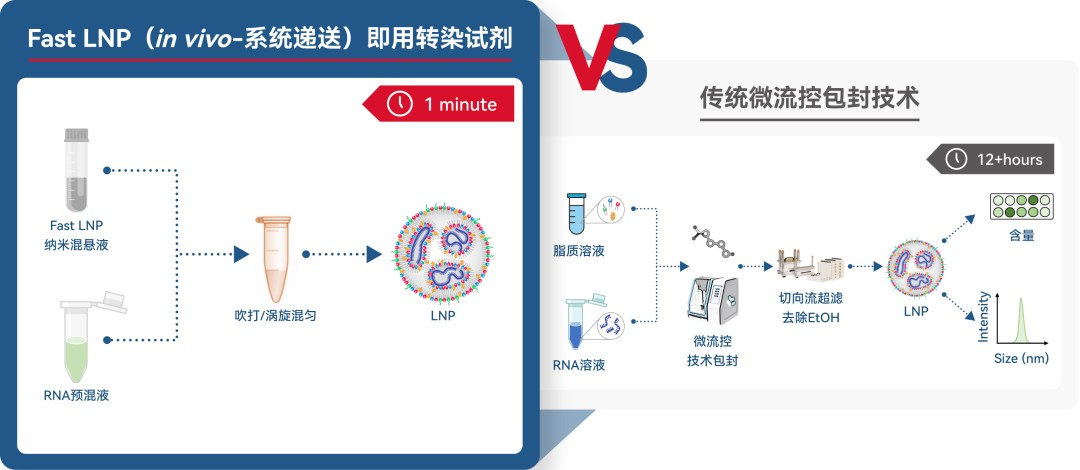
基于传统的 LNP 制备工艺繁琐,需要各类设备,导致早研或科研阶段应用成本高,通量受到极大限制。
瀚海新酶重磅推出LNP 快速包封试剂盒:(点击查看原文)即用型体内递送 LNP—Fast LNP(in vivo-系统递送)——通过脂质组分间的疏水性和相互分子间作用,仅需简单手混即能自发组装成 mRNA-LNP,助力早研或科研阶段快速靶点验证。



瀚海新酶在mRNA 生产和 LNP 制备方面,拥有先进技术和丰富经验,采用简洁快速,高稳定性、高质量的微流控技术进行mRNA-LNP 的制备,可提供不同规格的高产量、高纯度、高性价比的 mRNA 和 mRNA-LNP 的定制化服务,可根据客户需求定制不同粒径大小的 LNP,同时提供 mRNA-LNP 的包封率、粒径、PDI、Zeta 电位等相关质量控制检测服务。












请先 登录后发表评论 ~