背景概述 新型冠状病毒感染性肺炎(COVID-19)加快了 mRNA 疫苗发展。mRNA 疫苗从概念阶段到成功商业化应用,得益于脂质纳米颗粒(LNP)递送系统的成功开发和大规模制备工艺的成熟。mRNA
背景概述
新型冠状病毒感染性肺炎(COVID-19)加快了 mRNA 疫苗发展。mRNA 疫苗从概念阶段到成功商业化应用,得益于脂质纳米颗粒(LNP)递送系统的成功开发和大规模制备工艺的成熟。mRNA 疫苗的核心原理是在 mRNA 中编码抗原信息,将 mRNA 递送至宿主细胞的细胞质中,在体内表达并诱导抗原特异性免疫应答。mRNA 是单链分子,极易被体内的多种核酸酶降解。所以需要递送系统包裹辅助实现 mRNA 的高效胞内表达。LNP 是现阶段最成熟、最有效的 mRNA 递送载体,最早上市的两款 mRNA 新冠疫苗均是采用的 LNP 递送形式。
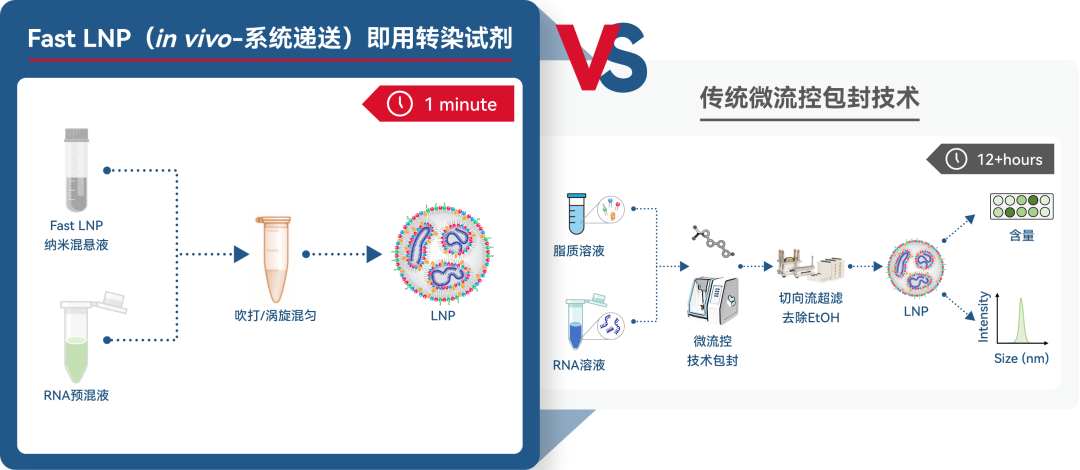
传统LNP制备工艺
mRNA-LNP 的递送原理:阳离子脂质与带负电荷的 mRNA 分子静电络合,形成复合体,提高 mRNA 分子的稳定性。mRNA- LNP 到达细胞膜时被内吞形成内体,随着内体 pH 值降低使可离子化脂质质子化,LNP 的双层结构遭受破坏,实现内体逃逸释放 mRNA,游离 mRNA 与核糖体结合,翻译成蛋白发挥作用。mRNA-LNP 有多种制备方法,微流控技术相对简便快速,封装效率高,均一性和批间重复性好,容易实现放大生产。在微流控包封中,乙醇中的脂质四组分与包含 mRNA 的酸性水相通过快速融合,在酸性 pH 条件下,可电离脂质离子化形成带有正电荷的脂质,与带负电荷的 mRNA 组成复合物,两相混匀过程中,随着乙醇相的稀释脂质的溶解度降低,乙醇相中脂质会经历凝结过程形成亲脂型和非亲脂型小粒径脂质体。再经过稀释和 TFF 去除乙醇并中和 pH,在此过程中小粒径脂质体与负载 mRNA 的复合体会发生络合和融合,形成了 20-200nm 大小的 LNP 系统。在早研阶段,往往需要大量的靶点筛选、序列优化来确定符合设计需求的药物靶点、UTR 及 CDS 序列。细胞和动物水平验证是最经典的 mRNA 序列筛选方法,但很多情况下,细胞水平的验证并不能完全反映体内的递送表达效果,动物水平的验证结果就显得尤其重要。现阶段体内递送的 mRNA-LNP 样品常用设备进行包封,但包封设备有死体积,及后处理流程的损耗,起始包封样品需求量大。此外设备包封LNP需要高精度设备和昂贵耗材,包封后需要复杂的下游超滤和纯化工艺,增加了实验复杂度和人力及耗材的费用投入。纯化后样品的质检成本高,多种检测方法需要高精度仪器和繁琐的质检步骤,延缓了早研阶段 mRNA 序列筛选的进度。
突破传统!
1min包封mRNA神器上线
针对以上痛点,瀚海新酶重磅推出即用型体内递送 LNP—Fast LNP(in vivo-系统递送):通过脂质组分间的疏水性和相互分子间作用,仅需简单手混即能自发组装成 mRNA-LNP。快速简便无需设备,操作简单无样品损耗,起始样本需求量低至 μg。且组分中不含有乙醇,安全性高,不需复杂的下游超滤和纯化工艺,无需复杂的样品质检流程。专为实验动物体内 RNA 递送开发的即用型 LNP 高效包封方案,利用 Fast LNP,可将动物体内验证的成本和周期大幅度降低,可跨过细胞水平验证,直接进行高精准、超快速、低成本、高安全性的mRNA 体内验证,广泛适用于 mRNA、gRNA、saRNA 等多种 RNA 类型。
高效1min包封mRNA
优势

应用场景
1. RNA药物动物体内评价
2. RNA序列体内高通量筛选
3. mRNA疫苗和药物研发
4. 基因编辑效率分析
5. 动物免疫和抗体制备
6. 微量RNA的LNP包封
产品应用
应用本产品,可跨过细胞水平验证,直接进行超快速、低成本的体内验证,特别是针对早研阶段 mRNA 序列多但是样品量少的情况,能精准、快速完成 mRNA 在动物体内的翻译水平或功能的验证与筛选。瀚海新酶可提供基于此产品的体内验证,直接输出体内表达效率结果,用专业的定制化方案推出优质的服务。可满足多种给药方式的快速体内验证
(数据展示)
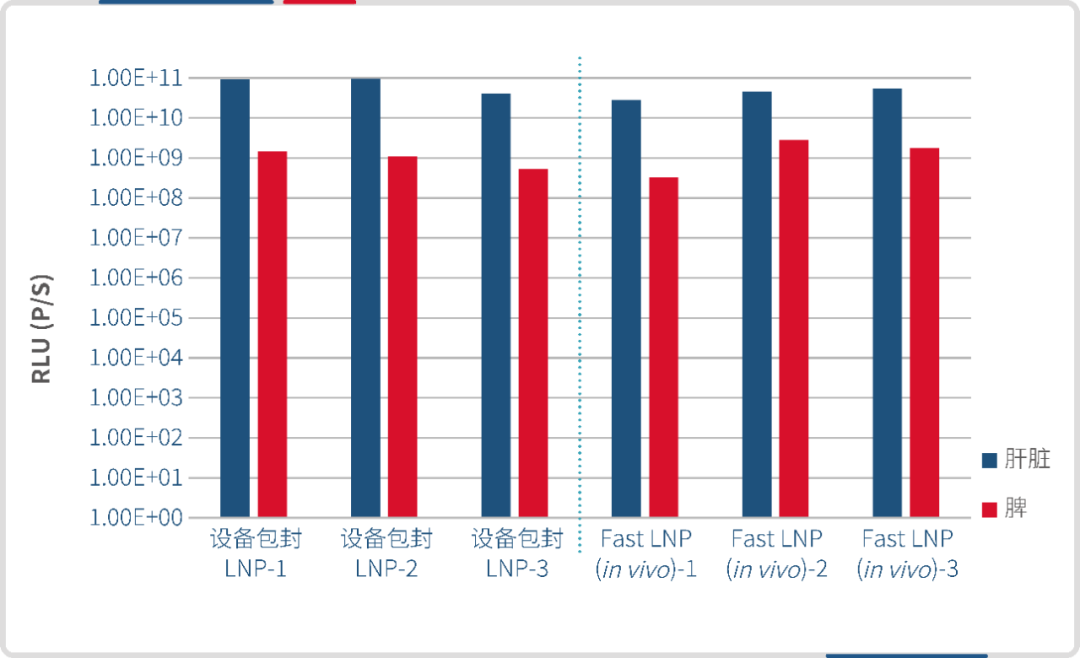
分别使用微流控制备的 LNP 和瀚海新酶的 Fast LNP(in vivo)进行尾静脉给药,单次给药剂量 30 μg /只,于 6h 后腹腔注射 D-荧光素钾盐,进行 IVIS 活体成像。结果显示,瀚海新酶 Fast LNP(in vivo)与微流控包封的 LNP 在肝脾组织的靶向效果相当。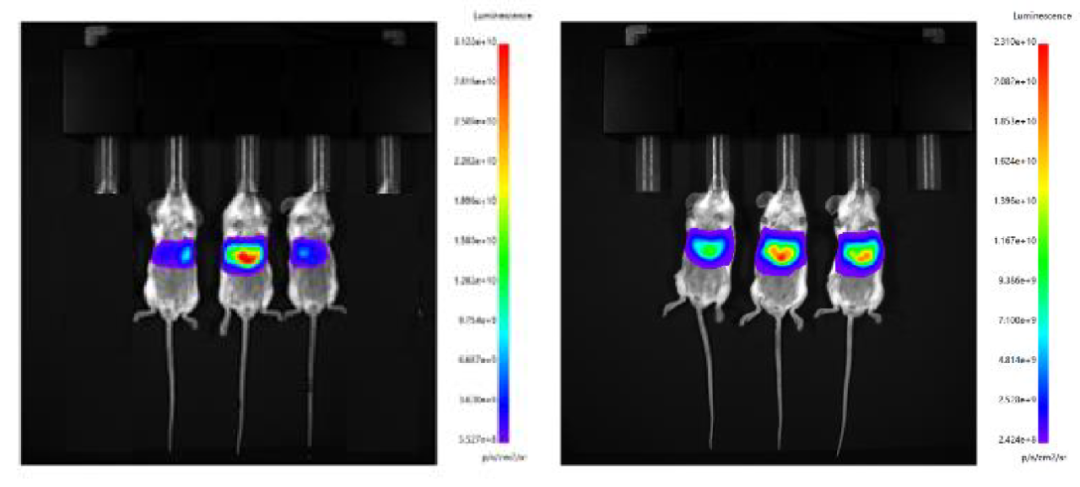 设备包封LNP(左)Fast LNP(in vivo)(右)
设备包封LNP(左)Fast LNP(in vivo)(右)
分别使用微流控制备的 LNP 和瀚海新酶的 Fast LNP(in vivo)进行肌肉给药,单次给药剂量 7.5 μg /只,于 6h 后腹腔注射 D-荧光素钾盐,进行 IVIS 活体成像。结果显示,瀚海新酶 Fast LNP(in vivo)与微流控包封的 LNP 在肝脾和肌肉的靶向效果相当。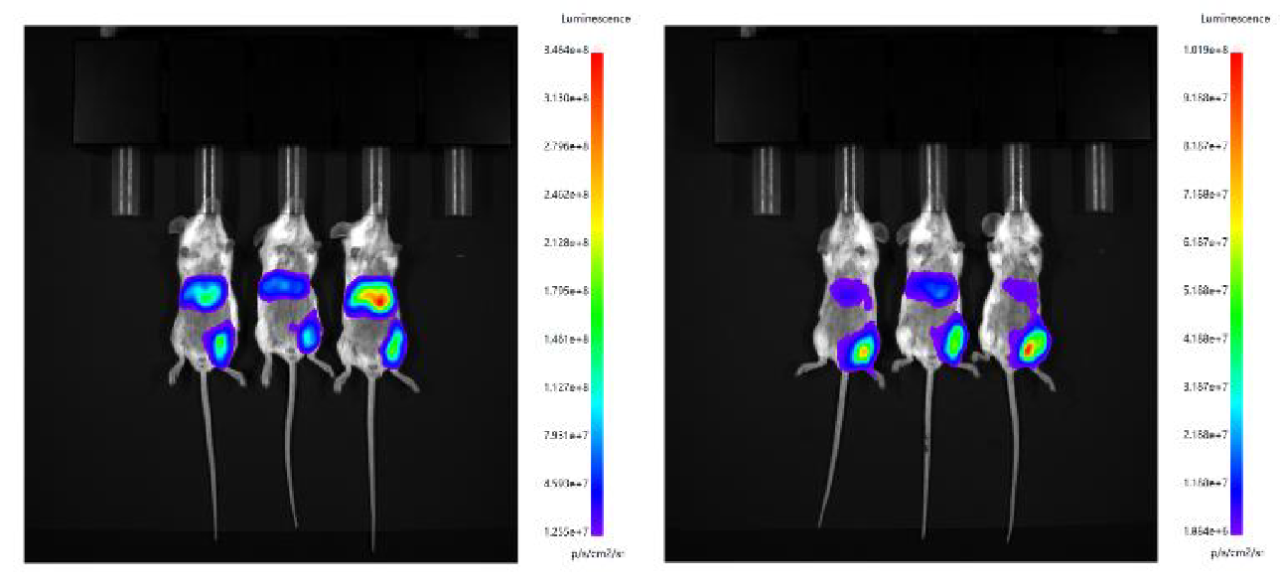
设备包封LNP(左)Fast LNP(in vivo)(右)
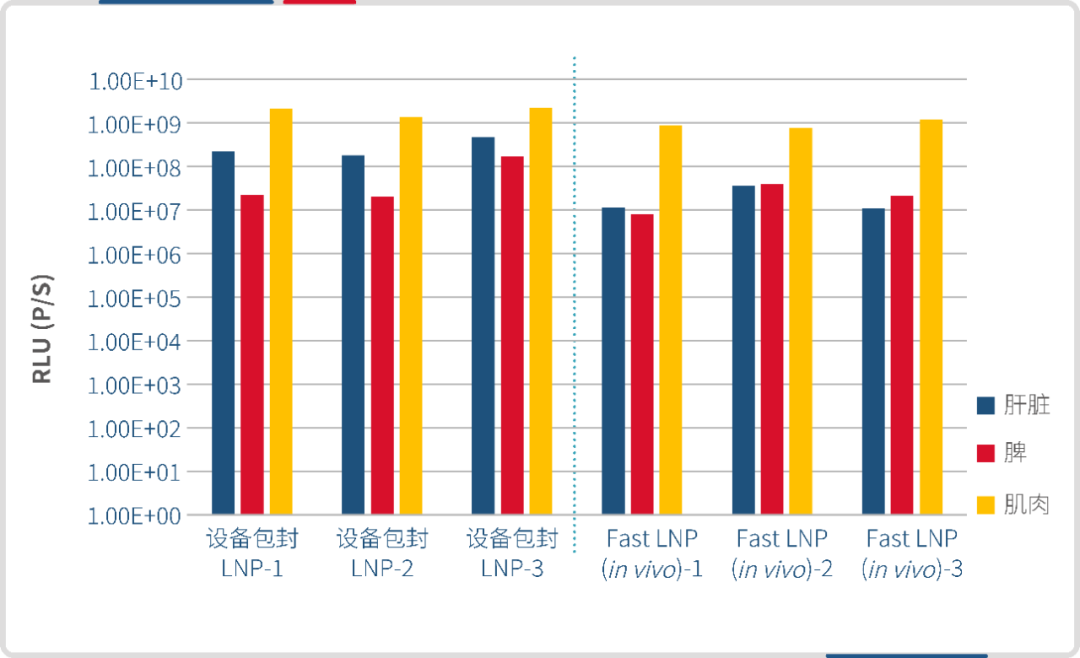
分别使用微流控制备的 LNP 和瀚海新酶的 Fast LNP(in vivo)进行腹腔给药,单次给药剂量 30 μg/只,于6h 后腹腔注射 D-荧光素钾盐,进行 IVIS 活体成像。结果显示,瀚海新酶 Fast LNP(in vivo)与微流控包封的 LNP 在肝脾组织的靶向效果相当。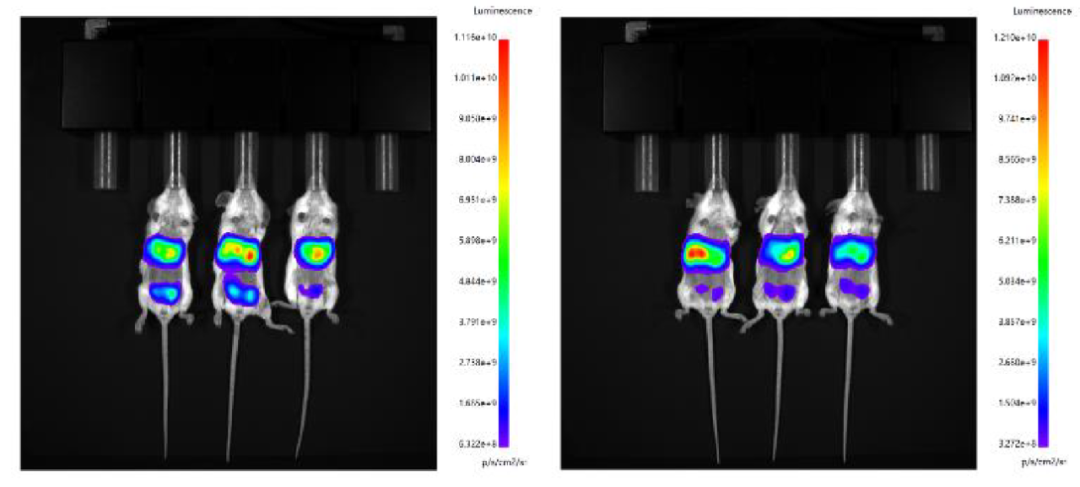 设备包封LNP(左)Fast LNP(in vivo)(右)
设备包封LNP(左)Fast LNP(in vivo)(右)
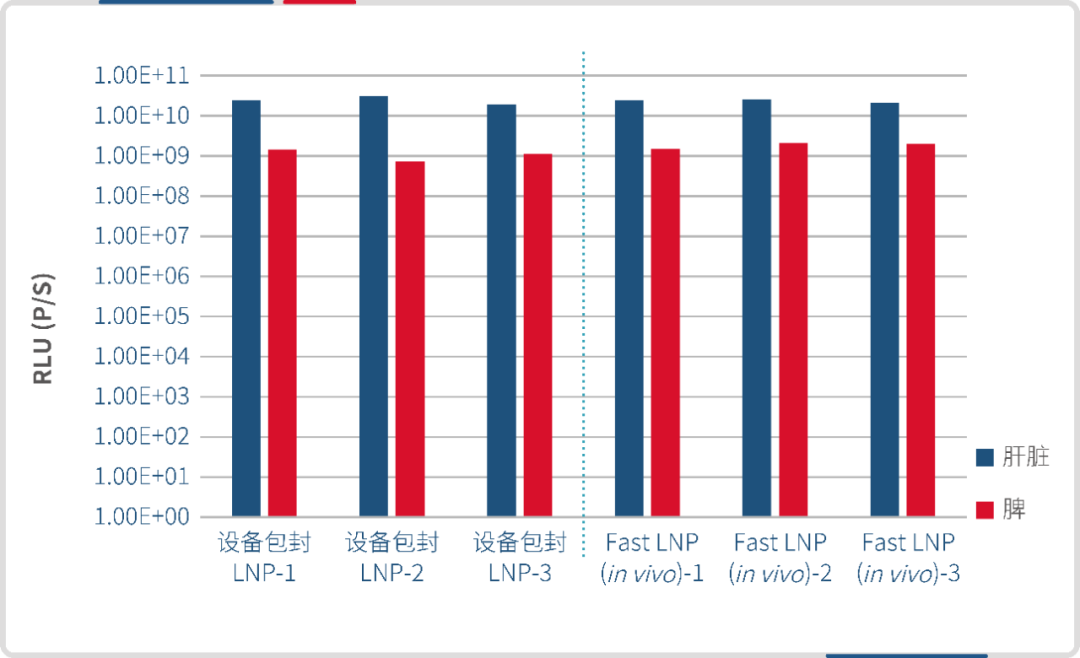
分别使用微流控制备的 LNP 和瀚海新酶的 Fast LNP(in vivo)进行皮下给药,单次给药剂量 30 μg/只,于 6h 后腹腔注射 D-荧光素钾盐,进行 IVIS 活体成像。结果显示,瀚海新酶 Fast LNP(in vivo)与微流控包封的 LNP 在皮下的靶向效果相当,Fast LNP(in vivo)在肝脾组织的靶向效果略弱。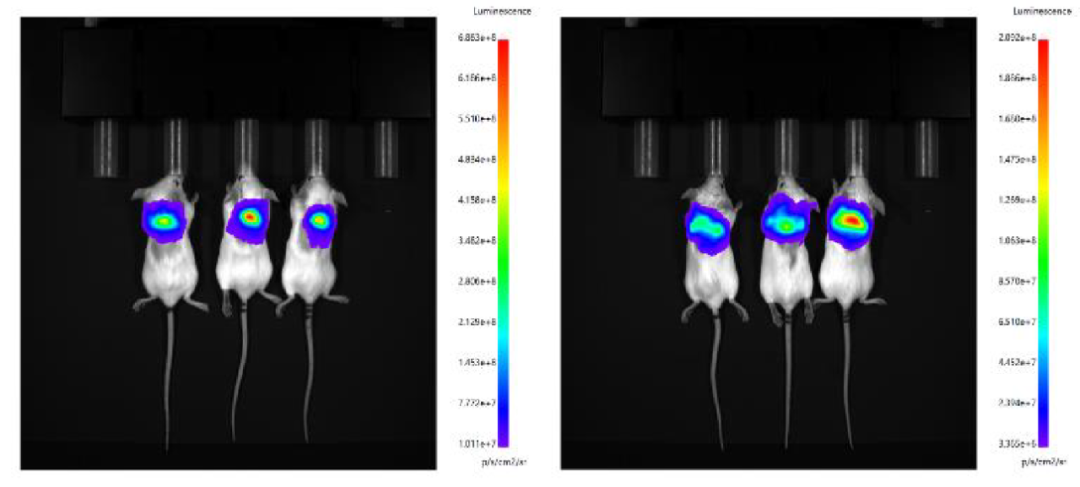
设备包封LNP(左)Fast LNP(in vivo)(右) 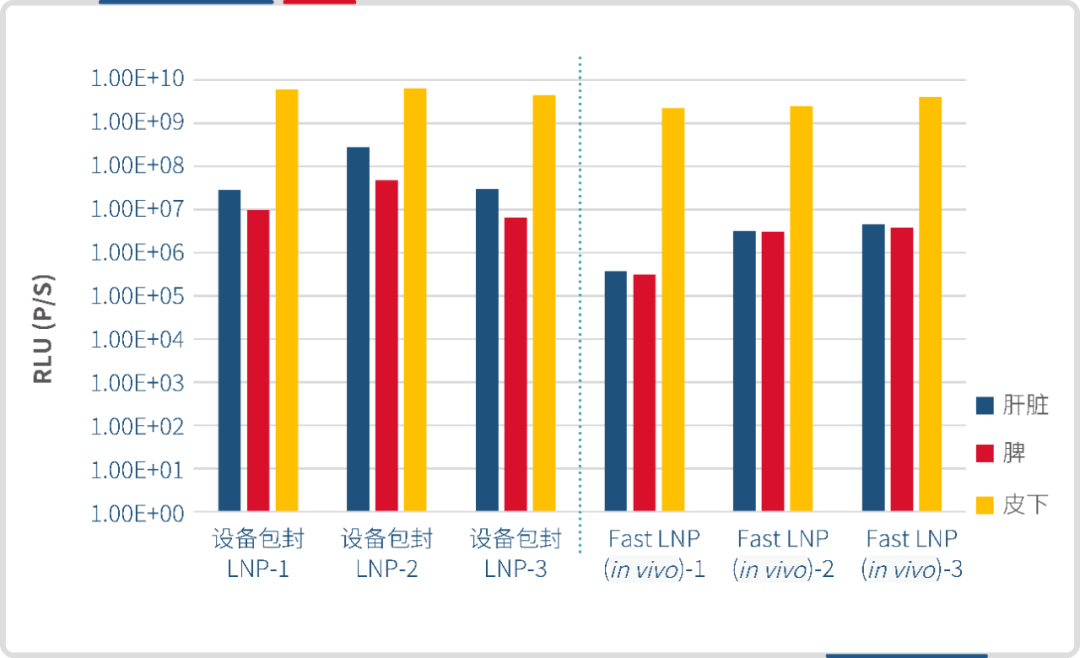
产品信息




 设备包封LNP(左)Fast LNP(in vivo)(右)
设备包封LNP(左)Fast LNP(in vivo)(右)



 设备包封LNP(左)Fast LNP(in vivo)(右)
设备包封LNP(左)Fast LNP(in vivo)(右)













请先 登录后发表评论 ~