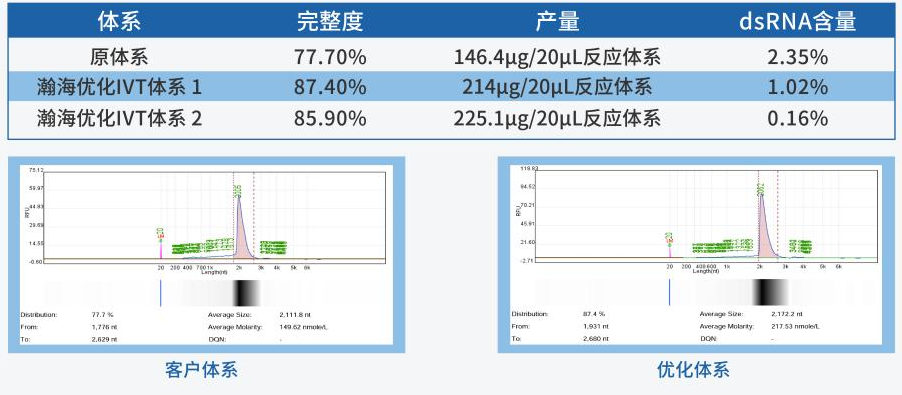
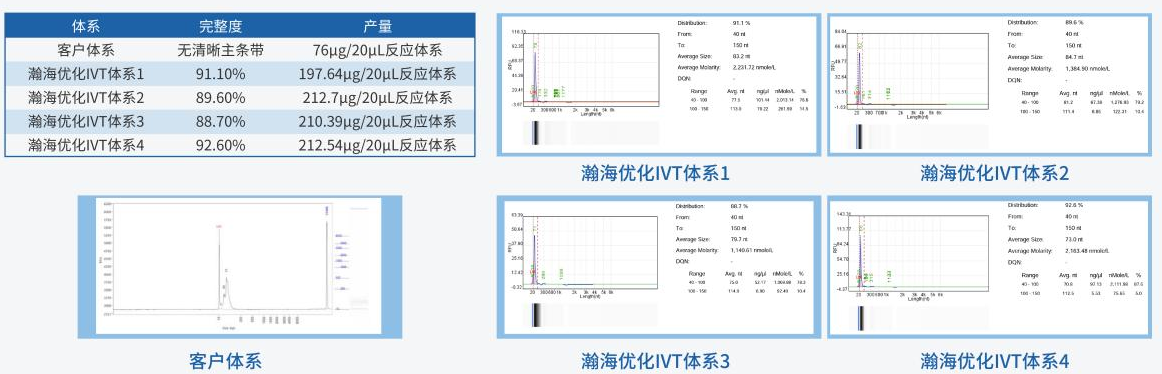
IVT工艺开发过程中,产物高产量与高完整度,是最先被关注的基础质量指标,高产量与生产成本息息相关,高完整度是产物质量的最基础指标。
T7 RNA聚合酶作为IVT翻译中最重要的原料,对于mRNA质量有决定性作用。瀚海新酶基于酶基因资源挖掘、酶定向进化、酶人工智能设计、酶大规模制造,以及酶催化体系的应用技术研发的五大技术平台,可提供mRNA合成全套物料,还可提供多种T7 RNA聚合突变体,并且基于对不同模板,不同突变体及IVT体系的深入研究,筛选并建立了自己的IVT Buffer库,满足客户各种生产需求及应用场景。


RUN | Test | Load | UFDF pool filter |
1 | 包封率(%) | 97.66 | 94.84 |
| 粒径(nm) | 67.37 | 71.51 | |
| PDI | 0.09 | 0.12 | |
2 | 包封率(%) | 95.69 | 95.00 |
| 粒径(nm) | 66.90 | 73.94 | |
| PDI | 0.13 | 0.16 |




包封/装载工艺的基础是递送系统的设计开发。良好设计的递送系统才能使mRNA分子进入人体后避免被RNA酶降解、被有效递送至靶点、穿过细胞膜并在胞内释放。瀚海采用的是目前主流的脂质纳米颗粒的递送系统。
mRNA-LNP包封制备的关键,除了脂质成分配方外,就是工艺过程的控制了,即如何控制mRNA与脂质成分的接触和相互作用过程,以形成稳定、均一、收率高的mRNA-LNP复合物。瀚海也是采用当前主流的微流控混合技术。由于mRNA溶于偏酸性水相,脂质体溶于乙醇,通过高压使mRNA溶液与脂质体溶液形成两股射流对冲混合,强烈的湍流使各组分充分混合,同时乙醇相被稀释,溶液pH变化,脂质体析出形成脂质纳米颗粒并与mRNA形成包封复合物。
mRNA包封后需要纯化去除未包封/装载的mRNA、游离的聚合物或脂质材料,并调整最终复合物浓度、置换溶剂缓冲体系、调节pH值等,此步骤通常通过切向流过滤实现,mRNA-LNP复合物被截留,杂质及溶剂被洗滤。以4000nt mRNA为例,包封后稀释20倍,利用中空纤维柱进行切向流过滤,下图工艺数据供参考。
将firefly luciferase mRNA-LNP递送到小鼠体内,数据显示mRNA-LNP成功表达在原位,靶向肝脏和脾脏。




以4000nt mRNA为例,纯化工艺相关数据如下:
Step | Cycle No. | Load | Elution | |||||||||
CE (%) | SEC_HPLC (H/M/L) (%) | Res. Protein (ug/mg) | Yield (%) | CE (%) | SEC_HPLC (H/M/L) (%) | Res. Protein (ug/mg) | dsRNA (ug/mg) | HCD (ug/mg) | Res.DNA template (ug/mg) | Endotoxin (EU/mg) | ||
TFF 1 | Cycle 1 | 76 | - | - | 100 | 78.8 | ND/97.3/2.8 | 8.5 | 0.69 | ND | 2.07E-15 | <9.4 |
AC | Cycle 1 | 71.5 | ND/97.9/2.1 | 6.3 | 92.1 | 82.5 | 3.7/95.1/1.2 | 0.2 | 0.60 | ND | 1.04E-15 | <17.5 |
Cycle 2 | 76.7 | ND/96.9/3.1 | 6.3 | 94.0 | 83.0 | 0.8/98.0/1.2 | 0.2 | 0.94 | ND | 9.36E-16 | <17.2 | |
TFF 2 | Cycle 1 | 82.8 | 3.6/95.4/0.9 | 0.2 | 99.6 | 82.5 | ND/99.6/0.4 | / | 0.68 | / | / | <6.8 |




瀚海新酶mRNA下游工艺的一般纯化流程及作用
下游工艺的纯化设计一般包括以下4个单元操作,可通过实施这些单元操作去除酶反应物、残留DNA和不需要的高分子量(HMW)物质等。
· 第一步UF/DF过滤。从接收IVT反应产物开始,然后UF/DF过滤器进行安装,用无核酸酶水冲洗,缓冲液平衡。接着将产物浓缩至目标体积,并洗滤置换到缓冲液中,最终通过对UF/DF组件进行清洗来回收产品。该操作的目的减少RNA聚合酶, DNA模板, NTPs, 加帽酶和试剂, 抑制剂等杂质, 并置换缓冲体系。
· 第二步是使用oligo dT填料捕获mRNA或者使用多模式核基球层析。前者以oligo dT(聚胸苷)配体(18-25 bp胸腺嘧啶脱氧核苷酸)和mRNA3‘末端的聚腺苷酸(PolyA尾巴)通过氢键形成稳定的杂交以捕获mRNA。目的:去除缺乏PloyA尾巴的杂质如游离核苷酸、短链转录本、酶等。后者为mRNA流穿填料,将流穿和漂洗液收集为单个馏分,进入下一步骤。此步骤的目的是去除IVT反应组分污染物。
· 第三步是UF/DF过滤进行浓缩换液。将目标产物置换到最终制剂缓冲液中,并对UF/DF组件进行顶洗,以回收产物。
· 第四步也是最后一步,0.2µm除菌过滤。然后将封闭的药物底物原液灌装到无菌容器中。应该注意的是,任何不能被检测确认为无核酸酶的管路、层析或过滤部件需在环境条件下用0.5M NaOH保持至少1小时,然后用无核酸酶水和适当的缓冲液冲洗以用于下一单元操作。
最后,这些纯化过的mRNA药物底物原液可以进行下一步,即包裸到LNP中。
纯化工艺开发及数据展示
在mRNA领域,除了设计优化mRNA的序列与开发高效、安全的递送载体,开发简单、快速、大规模且兼具经济效益的mRNA制备工艺也是mRNA技术最重要的创新之一。在mRNA的生产工艺中,IVT后的纯化对于最终mRNA产品的安全性和有效性非常重要,因为杂质的含量会影响mRNA的翻译效率,并改变免疫原性。因此需要进行杂质的去除,相关杂质包括残留底物、dsRNA、异常mRNA、DNA模板、蛋白酶残留等。常用的纯化手段包括超滤、层析、沉淀等。












