T7 RNA聚合酶作为IVT翻译中最重要的原料,对于mRNA质量有决定性作用。瀚海新酶基于酶基因资源挖掘、酶定向进化、酶人工智能设计、酶大规模制造,以及酶催化体系的应用技术研发的五大技术平台,可提供mRNA合成全套物料,还可提供多种T7 RNA聚合突变体,并且基于对不同模板,不同突变体及IVT体系的深入研究,筛选并建立了自己的IVT Buffer库,满足客户各种生产需求及应用场景。
mRNA检测服务
质量控制作为药物开发最重要的一环,对于药物成分、杂质等的分析是药物开发过程中的重中之重。瀚海新酶提供mRNA药物质检服务
质检项 | 质检方法 |
| 浓度 | Nanodrop法 |
| 浓度 | Nanodrop法 |
ELISA | |
完整性 | CE |
SEC-HPLC | |
dsRNA | ELISA |
DNA模板残留 | qPCR |
加帽率 | LC-MS |
加尾分布 | LC-MS |
产品相关杂质——聚体定量 | SEC-HPLC |

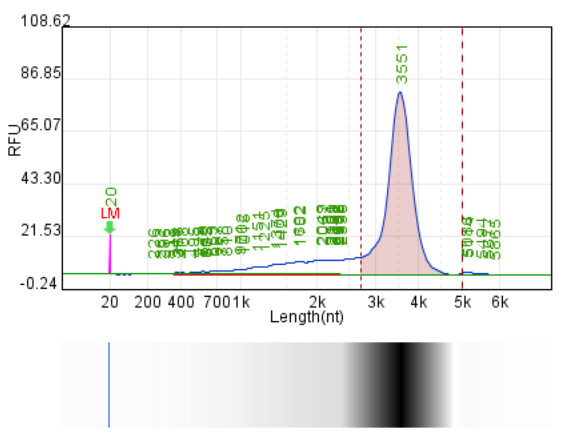



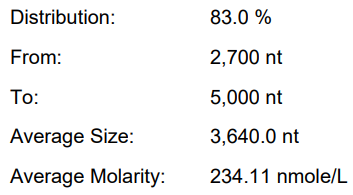
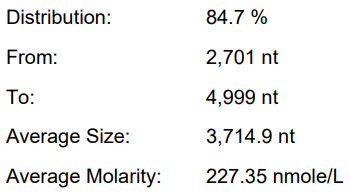
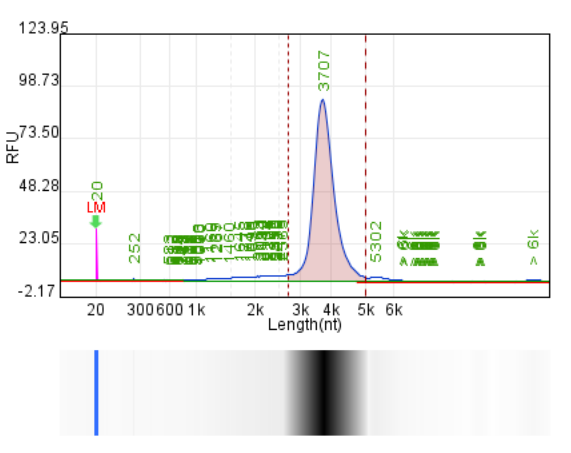
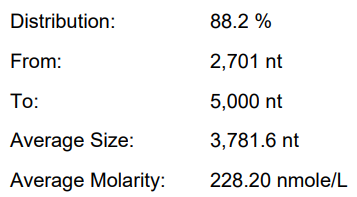

体系 | 完整度 | 产量 | 标dsRNA含量 |
原体系 | 77.70% | 146.4μg/20μL反应体系 | 2.35% |
瀚海优化IVT体系 1 | 87.40% | 214μg/20μL反应体系 | 1.02% |
瀚海优化IVT体系 2 | 85.90% | 225.1μg/20μL反应体系 | 0.16% |
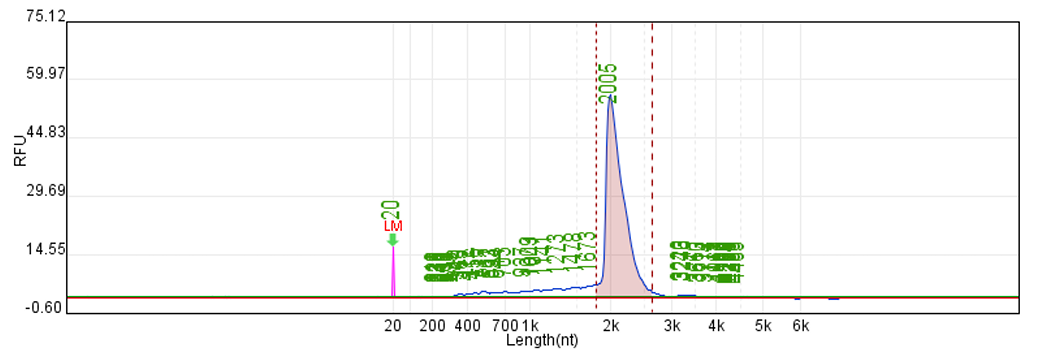




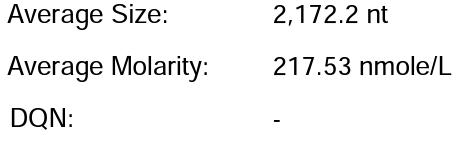

体系 | 完整度 | 产量 |
客户体系 | 无清晰主条带 | 76μg/20μL反应体系 |
瀚海优化IVT体系 1 | 91.10% | 197.64μg/20μL反应体系 |
瀚海优化IVT体系 2 | 89.60% | 212.7μg/20μL反应体系 |
瀚海优化IVT体系 3 | 88.70% | 210.39μg/20μL反应体系 |
瀚海优化IVT体系 4 | 92.60% | 212.54μg/20μL反应体系 |
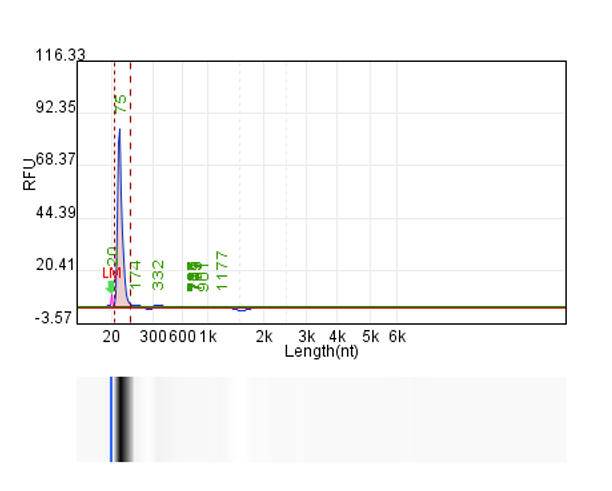
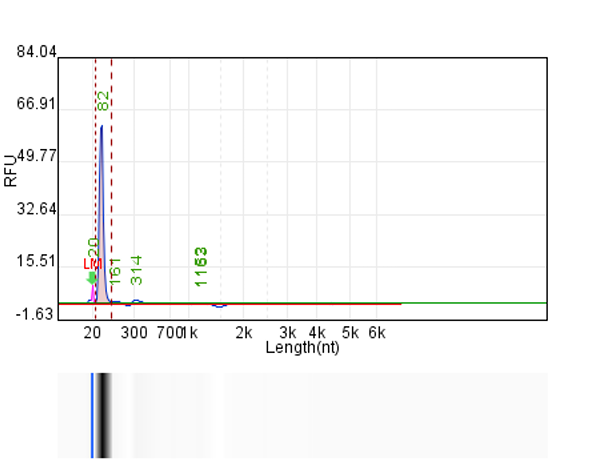
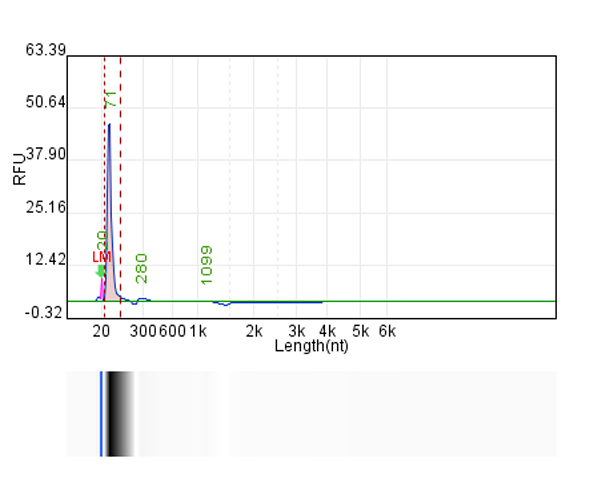
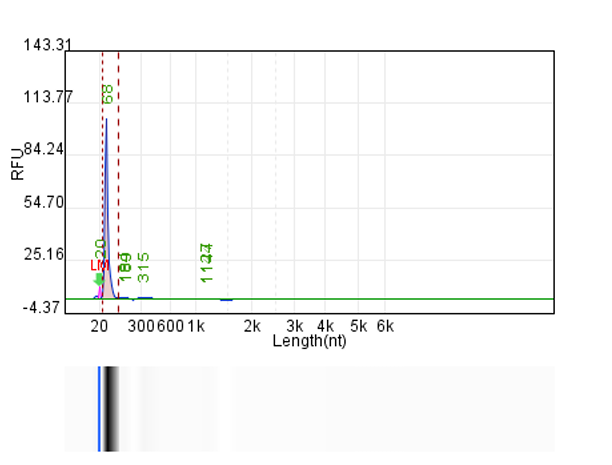
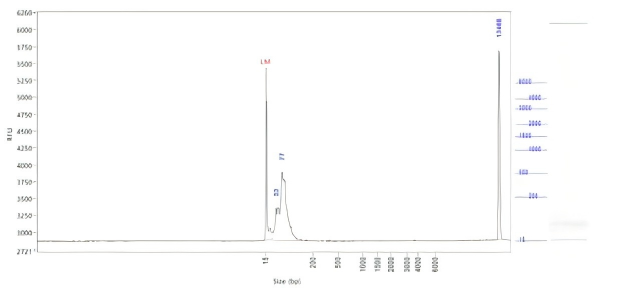
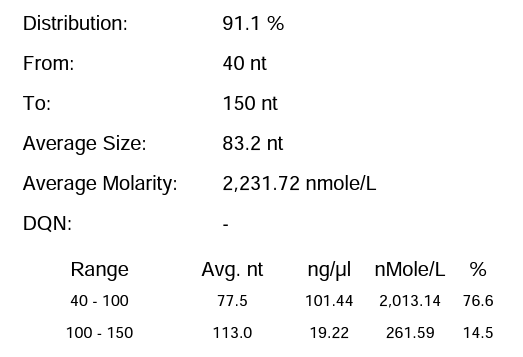
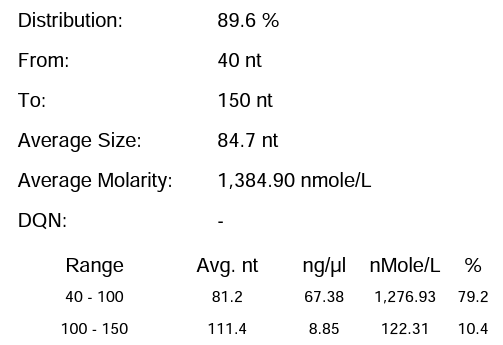
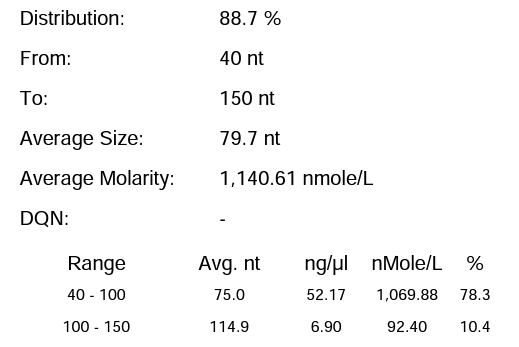
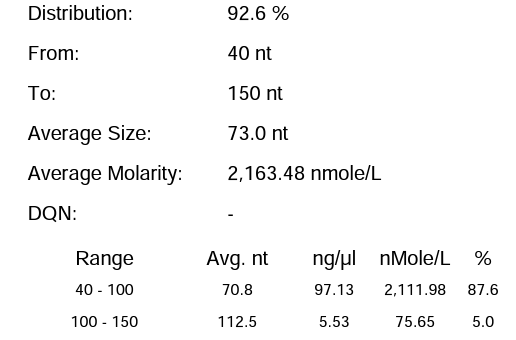

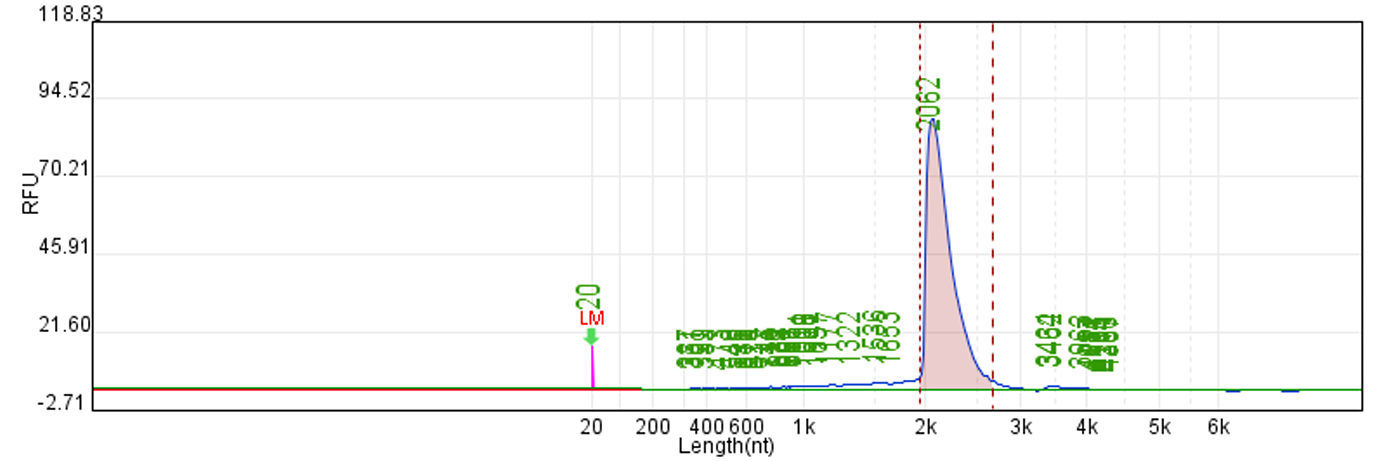
体系 | 完整度 | 产量 |
客户体系 | 88.67% | 222μg/20μL反应体系 |
瀚海优化IVT体系 1 | 90.24% | 228.5μg/20μL反应体系 |
瀚海优化IVT体系 2 | 91.82% | 231.4μg/20μL反应体系 |
瀚海优化IVT体系 3 | 91.63% | 233.3μg/20μL反应体系 |
瀚海优化IVT体系 4 | 89.04% | 215.7μg/20μL反应体系 |
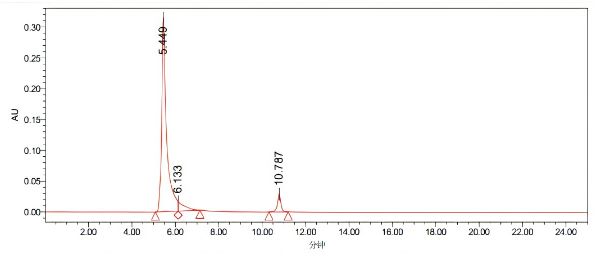
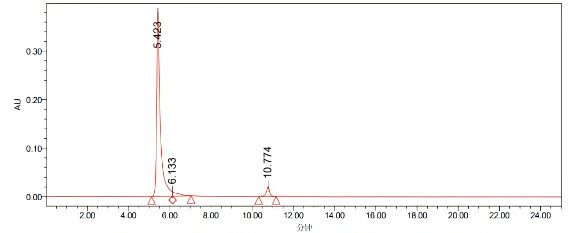
处理通道:PDA260.0纳米(PDA200.0到400.0纳米(在1.2纳米))
处理通道 | 保留时间(分钟) | 面积 | %面积 | 峰高 | |
1 | PDA 200.0纳米(PDA 200.0到400.0 纳米(在1.2 纳米)) | 5.440 | 4060130 | 88.67 | 31420 |
2 | PDA 200.0纳米(PDA 200.0到400.0 纳米(在1.2 纳米)) | 6.133 | 318002 | 5.68 | 15482 |
3 | PDA 200.0纳米(PDA 200.0到400.0 纳米(在1.2 纳米)) | 10.787 | 316960 | 5.66 | 28881 |
处理通道:PDA260.0纳米(PDA200.0到400.0纳米(在1.2纳米))
处理通道 | 保留时间(分钟) | 面积 | %面积 | 峰高 | |
1 | PDA 200.0纳米(PDA 200.0到400.0 纳米(在1.2 纳米)) | 5.423 | 4725664 | 91.82 | 380268 |
2 | PDA 200.0纳米(PDA 200.0到400.0 纳米(在1.2 纳米)) | 6.133 | 181471 | 3.53 | 8910 |
3 | PDA 200.0纳米(PDA 200.0到400.0 纳米(在1.2 纳米)) | 10.744 | 239565 | 4.65 | 20556 |
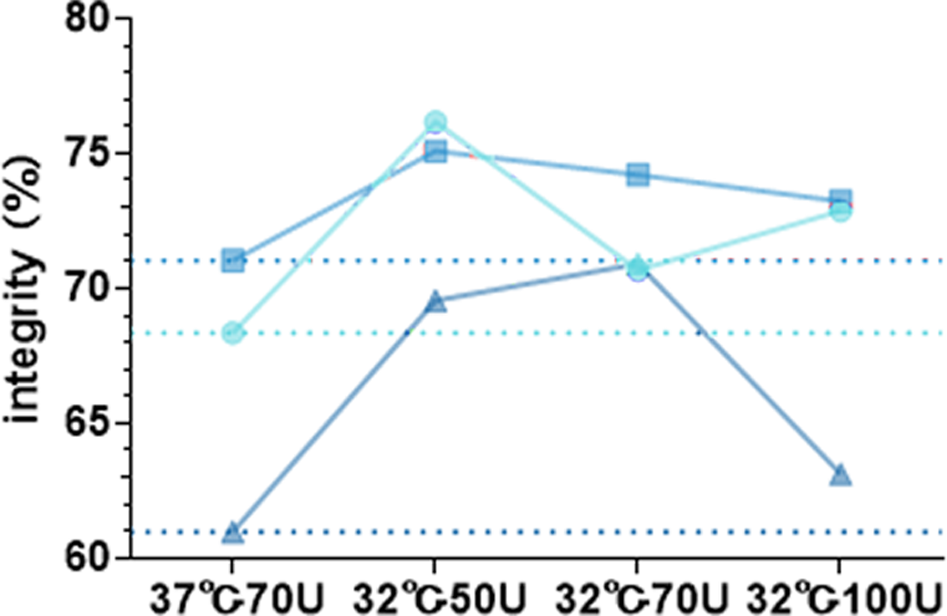
温度 | 酶 | 酶量 | mRNA 1(9016nt) | mRNA 2(8497nt) | mRNA 3(10255nt) | |||
产量(μg) | 完整度 | 产量(μg) | 完整度 | 产量(μg) | 完整度 | |||
32℃ | M6 | 50U | 63.35 | 76.16% | 74.95 | 75.08% | 92.7 | 69.55% |
70U | 85.8 | 70.67% | 106.7 | 74.20% | 108.6 | 70.91% | ||
100U | 108.55 | 72.87% | 130.8 | 73.22% | 122 | 63.12% | ||
37℃ | M6 | 70U | 200.15 | 68.34% | 219.85 | 71.02% | 213.05 | 60.97% |



以4000nt mRNA为例,纯化工艺相关数据如下:
Step | Cycle No. | Load | Elution | |||||||||
CE (%) | SEC_HPLC (H/M/L)(%) | Res.Protein (ug/mg) | Yield(%) | CE(%) | SEC_HPLC (H/M/L)(%) | Res.Protein (ug/mg) | dsRNA (ug/mg) | HCD (ug/mg) | Res.DNAtemplate (ug/mg) | Endotoxin (EU/mg) | ||
TFF 1 | Cycle 1 | 76 | - | - | 100 | 78.8 | ND/97.3/2.8 | 8.5 | 0.69 | ND | 2.07×10-15 | <9.4 |
AC | Cycle 1 | 71.5 | ND/97.9/2.1 | 6.3 | 92.1 | 82.5 | 3.7/95.1/1.2 | 0.2 | 0.60 | ND | 1.04×10-15 | <17.5 |
Cycle 2 | 76.7 | ND/96.9/3.1 | 6.3 | 94.0 | 83.0 | 0.8/98.0/1.2 | 0.2 | 0.94 | ND | 9.36×10-16 | <17.2 | |
TFF 2 | Cycle 1 | 82.8 | 3.6/95.4/0.9 | 0.2 | 99.6 | 82.5 | ND/99.6/0.4 | / | 0.68 | / | / | <6.8 |




瀚海新酶mRNA下游工艺的一般纯化流程及作用
· 第一步 UF/DF过滤:将IVT反应产物浓缩至目标体积,并通过洗滤置换到缓冲液中,并减少RNA聚合酶、DNA模板、NTPs、加帽酶和试剂、抑制剂等杂质。
· 第二步 捕获mRNA:使用oligo dT填料捕获含PolyA尾的mRNA,去除如游离核苷酸、短链转录本、酶等IVT反应组分杂质。
· 第三步 UF/DF浓缩换液:使用UF/DF进行浓缩换液,将目标产物置换到最终制剂缓冲液中。
· 第四步 除菌过滤:进行0.22µm滤膜除菌过滤。
最后,这些纯化过的mRNA药物底物原液可以进行下一步,即包封到LNP中。
纯化工艺开发及数据展示
在mRNA领域,除了设计优化mRNA的序列与开发高效、安全的递送载体,开发简单、快速、大规模且兼具经济效益的mRNA制备工艺也是mRNA技术最重要的创新之一。在mRNA的生产工艺中,IVT后的纯化对于最终mRNA产品的安全性和有效性非常重要,因为杂质的含量会影响mRNA的翻译效率,并改变免疫原性。因此需要进行杂质的去除,相关杂质包括残留底物、dsRNA、异常mRNA、DNA模板、蛋白酶残留等。常用的纯化手段包括超滤、层析、沉淀等。











mRNA纯化质检项
质检项 | 质检方法 |
| 浓度 | Nanodrop法 |
ELISA | |
完整性 | CE |
SEC-HPLC | |
DNA模板残留 | qPCR |
加帽率 | LC-MS |
加尾分布 | LC-MS |
| 总蛋白残留 | Nanoorange |
产品相关杂质——NTP残留 | SEC-HPLC |
| 产品相关杂质——聚体定量 | SEC-HPLC |
| 产品相关杂质——残留T7RNA聚合酶含量 | ELISA |
| 内毒素 | 鲎试剂 |
RUN | Test | Load | UFDF pool filter |
1 | 包封率(%) | 97.66 | 94.84 |
粒径(nm) | 67.37 | 71.51 | |
PDI | 0.09 | 0.12 | |
2 | 包封率(%) | 95.69 | 95.00 |
粒径(nm) | 66.90 | 73.94 | |
PDI | 0.13 | 0.16 |




包封/装载工艺的基础是递送系统的设计开发。良好设计的递送系统才能使mRNA分子进入人体后避免被RNA酶降解、被有效递送至靶点、穿过细胞膜并在胞内释放。瀚海采用的是目前主流的脂质纳米颗粒的递送系统。
mRNA-LNP包封制备的关键,除了脂质成分配方外,就是工艺过程的控制了,即如何控制mRNA与脂质成分的接触和相互作用过程,以形成稳定、均一、收率高的mRNA-LNP复合物。瀚海也是采用当前主流的微流控混合技术。由于mRNA溶于偏酸性水相,脂质体溶于乙醇,通过高压使mRNA溶液与脂质体溶液形成两股射流对冲混合,强烈的湍流使各组分充分混合,同时乙醇相被稀释,溶液pH变化,脂质体析出形成脂质纳米颗粒并与mRNA形成包封复合物。
mRNA包封后纯化去除未包封/装载的mRNA、游离的聚合物或脂质材料,并调整最终复合物浓度、置换溶剂缓冲体系、调节pH值等。通过切向流过滤技术,能充分截留mRNA-LNP,同时洗滤杂质及置换溶剂。同时瀚海建立了一系列的mRNA-LNP质控放行标准,对LNP包封及纯化工艺的优化的结果严格把控。




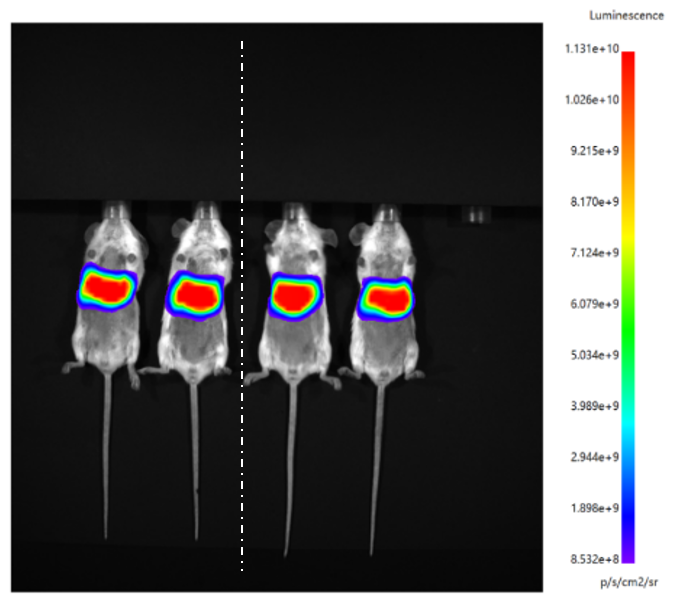

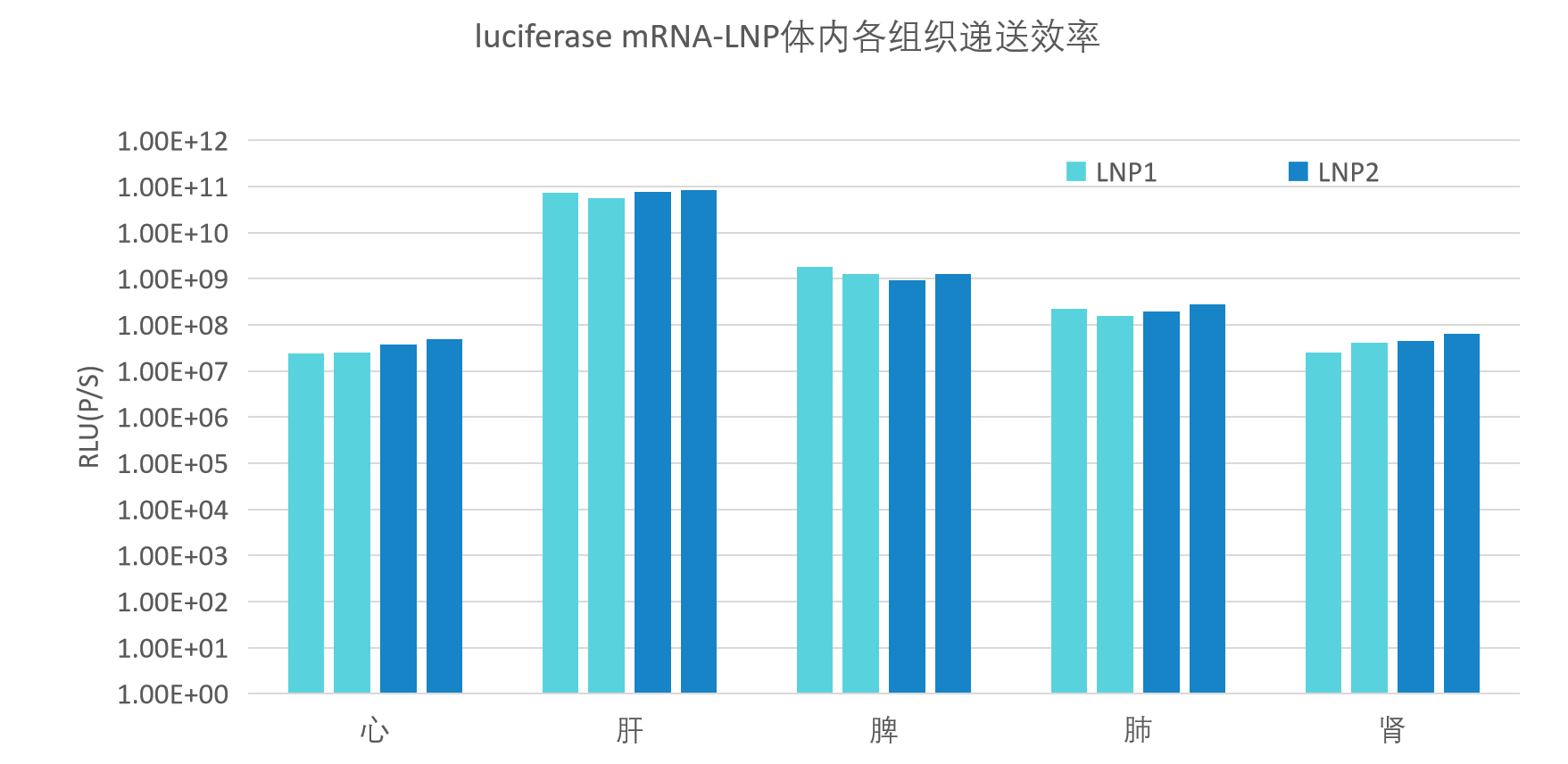
mRNA-LNP质检项
质检项 | 质检方法 |
| 包封率 | Ribogreen |
| 制剂RNA浓度 | |
| PDI/粒径 | DLS |
Zeta电位 | 多普勒电泳 |
| 多价RNA分子摩尔比 | ddPCR+qPCR |
RNA序列确认 | sanger测序/RT-PCR |
脂质含量测定 | ELSD-HPLC |
RNA完整度 | CE/HPLC |
内毒素 | 重组C因子/鲎试剂 |
蛋白表达验证 | WB/FACS/IF/ELISA |

